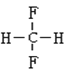
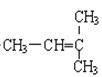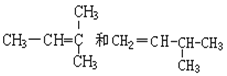题目内容
【题目】在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )

A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
【答案】D
【解析】
由曲线变化图可知,随反应进行HCO3-的物质的量增大,故HCO3-是生成物,根据碳元素守恒, CNO-应是反应物,N2是生成物;ClO-物质的量减小,ClO-是反应物,Cl-是生成物。ClO-中氯元素化合价降低,ClO-是氧化剂;CNO-中N元素化合价由-3升高为0,CNO-是还原剂。根据得失电子守恒,反应离子方程式是3ClO-+2CNO- +H2O = N2+2HCO3- +3Cl-。
A. ClO-是反应物,Cl-是生成物,ClO-中氯元素化合价降低,ClO-是氧化剂,CNO-中N元素化合价由-3升高为0,CNO-是还原剂,故A错误;
B. 氯元素化合价降低,Cl-是还原产物,N元素化合价由-3升高为0,氮气是氧化产物,还原产物与氧化产物的物质的量之比为3∶1,故B错误;
C. 根据方程式生成1mol N2转移6mol电子;在标准状况下,产生4.48 L N2时转移![]() 1.2 mol电子,故C 错误;
1.2 mol电子,故C 错误;
D. 上述反应中,只有N、Cl两种元素化合价发生了变化,故D正确。

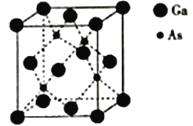
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
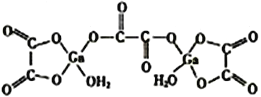
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。