题目内容
【题目】按要求回答下列问题:
(1)2,3—二乙基—1,3—戊二烯用H2完全加成后产物的名称:_________________________
(2)组成为C3H6Br2的卤代烃,同分异构体有_________种
(3)碳原子数小于10的烷烃中,一氯取代物没有同分异构体的烷烃共有_________种
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为__________。
(5)实验室制取乙炔的化学方程式:_______________________________________
(6)2—甲基—1,3—丁二烯加聚反应方程式:________________________________
(7)甲苯制取TNT的化学方程式:____________________________________________
(8)等物质的量的甲烷、乙烯、乙炔、苯等四种有机物分别完全燃烧,需要O2最多的是__;等质量的上述四种物质分别完全燃烧,需要O2最多的是____。
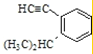
(9)写出间甲基苯乙烯的结构简式______________________________;
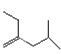
(10)与H2加成生成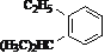 的炔烃的结构简式____________;
的炔烃的结构简式____________;
(11)写出4-甲基-2-乙基-1-戊烯的键线式__________________________。
【答案】3—甲基—4—乙基已烷 4 4 CH3CH2CH(OH)CH3 CaC2+2H2O=Ca(OH)2+C2H2↑ n![]()
![]()
![]() +3HO-NO2
+3HO-NO2 ![]()
![]() +H2O 苯 甲烷
+H2O 苯 甲烷 
【解析】
(1)2,3—二乙基—1,3—戊二烯用H2完全加成后二烯烃生成烷烃,烷烃的碳键最长的为6个碳,产物的名称为:3—甲基—4—乙基已烷;
(2)组成为C3H6Br2的卤代烃,同分异构体有1,1-二溴丙烷、2,2-二溴丙烷、1,2-二溴丙烷、1,3-二溴丙烷共4种;
(3)碳原子数小于10的烷烃中,一氯取代物没有同分异构体的烷烃有甲烷、乙烷、2,2-二甲基丙烷、2,2,3,3-四甲基丁烷共4种;
(4)C4H10O的同分异构体中属于醇类的有多种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3;
(5)实验室利用电石与水反应制取乙炔,反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(6)2—甲基—1,3—丁二烯加聚反应方程式:n![]()
![]()
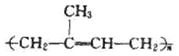 ;
;
(7)甲苯与浓硝酸反应制取TNT,反应的化学方程式为:![]() +3HO-NO2
+3HO-NO2 ![]()
![]() +H2O;
+H2O;
(8)(1)等物质的量的四种有机物,分别在氧气中完全燃烧,1mol物质耗氧量为:
1mol甲烷CH4耗氧量为2mol;
1mol乙烯C2H4耗氧量为3mol;
1mol乙炔C2H2耗氧量为2.5mol,
1mol苯C6H6耗氧量为7.5mol,故耗氧量最多的是苯;
等质量的上述四种有机物完全燃烧耗氧量取决于H元素的含量,H元素含量越高,耗氧量越多,根据CxHy中![]() 值判断,该值越大耗氧量越多:甲烷CH4,乙烯C2H4最简式为为CH2,乙炔C2H2最简式为为CH,苯C6H6的最简式为CH,甲烷中H元素质量分数最大,所以甲烷CH4耗氧量最大,故答案为:苯;甲烷;
值判断,该值越大耗氧量越多:甲烷CH4,乙烯C2H4最简式为为CH2,乙炔C2H2最简式为为CH,苯C6H6的最简式为CH,甲烷中H元素质量分数最大,所以甲烷CH4耗氧量最大,故答案为:苯;甲烷;
(9)间甲基苯乙烯,该有机物的苯环上乙烯基的间位含有一个甲基,该有机物结构简式为: ;
;
(10) 的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为:
的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为: ;
;
(11)4-甲基-2-乙基-1-戊烯的键线式为 。
。

【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
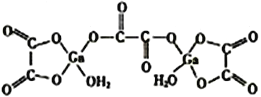
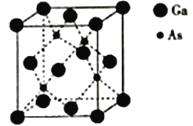
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。