题目内容
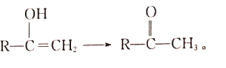
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
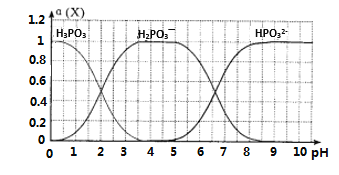
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
【答案】PCl3+3H2O=H3PO3+3H++3Cl- 正盐 2∶1 8.3×10-3 mol·L-1 = H2PO3-+OH-=HPO32-+H2O
【解析】
(1)PCl3水解可制取亚磷酸和盐酸,水解方程式为PCl3+3H2O=H3PO3+3HCl,故答案为:PCl3+3H2O=H3PO3+3HCl;
(2)由题意可知亚磷酸是具有强还原性的二元弱酸,则Na2HPO3是亚磷酸的正盐,故答案为:正盐;
(3)由题意可知,亚磷酸可以被银离子氧化为磷酸,银离子被还原生成银,反应的离子方程式为:H3PO3+2Ag++H2O=2Ag+H3PO4+2H+,由方程式可知氧化剂Ag+与还原剂H3PO3的物质的量之比为2:1,故答案为:2:1;
(4)由某温度下,0.10molL-1的H3PO3溶液c(H+)=2.5×10-2molL-1可知,溶液中c(H2PO3-)=2.5×10-2molL-1,则H3PO3的一级电离平衡常数Ka1=![]() =
=![]() ≈8.3×10-3,故答案为:8.3×10-3;
≈8.3×10-3,故答案为:8.3×10-3;
(5)向H3PO3溶液中滴加NaOH溶液至中性时,溶液中c(H+)=c(OH-),由溶液中存在电荷守恒关系c(Na+)+c(H+)=c(H2PO3-)+2c(HPO32-)+c(OH-)可知,溶液中c(Na+)=c(H2PO3-)+2c(HPO32-),故答案为:=;
(6)以酚酞为指示剂,当溶液由无色变为浅红色时,溶液的pH大于10,由图可知,亚磷酸与NaOH溶液反应生成HPO32—,反应的离子方程式为H2PO3-+OH-=HPO32-+H2O,故答案为:H2PO3-+OH-=HPO32-+H2O。