��Ŀ����
����Ŀ���ҹ��н϶�Ŀ�����Ա���о���ȩ���������������HCHO(![]() )��O2���ǻ���ʯ(HAP)�������������CO2��H2O�����̣�������ʾ��ͼ��ͼ��ͼ��ֻ������HAP�IJ��ֽṹ����
)��O2���ǻ���ʯ(HAP)�������������CO2��H2O�����̣�������ʾ��ͼ��ͼ��ͼ��ֻ������HAP�IJ��ֽṹ����

����˵����ȷ���ǣ� ��
A.�÷�Ӧ������������CO2
B.HCHO�ڷ�Ӧ��������C=O����������
C.����ͼʾ��Ϣ��CO2�����е���ԭ��ȫ������O2
D.HAP�����HCHO��O2Ӧ�Ļ�ܣ������ı䷴Ӧ·��
���𰸡�A
��������
A���������Ϣ��HCHO��O2���ǻ���ʯ(HAP)�������������CO2��H2O��HCHO�е�C��0��������+4�ۣ�����ԭ�������Ӧ���ɵ�CO2Ϊ�������Aѡ����ȷ��
B������ͼʾ��������Ӧ�����У�HCHO�ڷ�Ӧ��������C��H���Ķ��Ѻ�C=O�����γɣ�Bѡ�����
C����ͼʾ��֪��CO2��������ԭ��һ����������O2��һ���ֻ�������HCHO��Cѡ�����
D��HAP�ڷ�Ӧ�����������ɽ���HCHO��O2Ӧ�Ļ�ܣ�Dѡ����
��ѡA��

����Ŀ�������������Ʒ�У��й����ʵ�������������ȷ���ǣ� ��
ѡ�� | ������Ʒ | ���� | ��Ҫ�ɷ� | ���� |
A |
| PP������������ƿ | �۱�ϩ | �ܹ�ʹ���Ը��������ɫ |
B |
| ���� | ��֬������ | ������ˮ��Һ�ʼ��� |
C |
| ���� | �����ǡ����Ǻ����� | ������ϡ����������¿�ˮ�����������Ǻ��� |
D |
| ���� | ¿��Ƥȥë���ƶ��ɵĽ��� | �ں��ʵ�ø���������ܹ�����ˮ�ⷴӦ |
A.AB.BC.CD.D
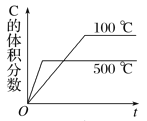
����Ŀ������β����Ⱦ���������ŷŵķ�����ɵĻ�����Ⱦ����Ҫ��Ⱦ��Ϊһ����̼��̼�⻯�������������ȣ�������Ͷ���ֲ��Σ�����������β���������Ҫ�������о���Ч������ʹβ���е�һ����̼�͵������ﷴӦ��ת��������Ⱦ�ĵ����Ͷ�����̼��
�ش��������⣺
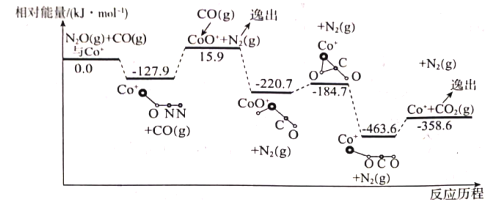
(1)��Co+�Ĵ������£�CO(g)��ԭN2O(g)�ķ�Ӧ���̺������仯��ͼ��ʾ(�ݳ���������Ϊ״̬�·����仯����ͼ����ȥ)����֪�ܷ�Ӧ�Ļ�ѧ����ʽΪ��CO(g)+N2O(g)![]() CO2(g)+N2(g)��
CO2(g)+N2(g)��
�÷�Ӧ���������У�
��һ����Co+(s)+N2O(g)![]() CoO+(s)+N2(g) ��H1=+15.9kJmol-1��
CoO+(s)+N2(g) ��H1=+15.9kJmol-1��
�ʶ�����___����H2=___��
����д�ڶ�����Ӧ���Ȼ�ѧ����ʽ�������ݷ�Ӧ����ͼ�����H2����ֵ��
�ڸ÷�Ӧ���������(���)Ϊ___��
(2)500�������£����ݻ���Ϊ2L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ�����������Ӧ���������������±���
���� | ��Ӧ��Ͷ����� | ƽ��ʱ n(N2/mol) | �ﵽƽ������ʱ��/min | ƽ��ʱ�����仯/kJ |
�� | 1molCO��1molN2O | n1 | t1 | ����Q1 |
�� | 2molCO��2molN2O | n2 | t2 | ����Q2 |
�� | 2molCO2��2molN2 | n3 | t3 | ����Q3 |
��Q1+![]() ___358.6(����>����=������<����ͬ��t1___t2��
___358.6(����>����=������<����ͬ��t1___t2��
��500�������£��Һͱ�������������������N2O�����ʵ�������x(N2O)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
�� | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
�� | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
��������ʵ�������������������0~20sʱ���ڵĻ�ѧ��Ӧ����v(CO)=___���÷�Ӧ��ƽ�ⳣ��K��ֵΪ��___��(����3λ��Ч����)
�����ƲⲢ��ͼ�л�����������x(N2O)��ʱ��仯�Ĺ�ϵͼ���ǡ�ôﵽƽ��ʱ�̵��λ��___��

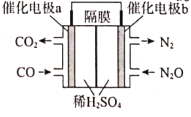
(3)����CO(g)��ԭN2O(g)�ķ�Ӧ��Ƴ���ͼ��ԭ���װ�ã���õ�������ĵ缫��ӦʽΪ___��
����Ŀ����������ĵ���ƽ�ⳣ�������
���� | HCOOH | HClO | H2CO3 | H2SO3 |
����ƽ�� ������25�棩 | Ka��1.77��10��4 | Ka��4.0��10��8 | Ka1��4.3��10��7 Ka2��4.7��10��11 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
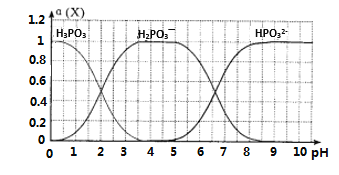
��1�������¢�0.1mol��L-1HCOONa����0.1mol��L-1NaClO����0.1mol��L-1Na2CO3����0.1mol��L-1NaHCO3������Һ��pH�ɴ�С�Ĺ�ϵΪ________________�����������գ�
��2��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ________________��
��3���������ӷ���ʽ��ȷ����___________������ĸ����
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2��
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
��4��ij�¶ȣ�T�棩�µ���Һ�У�c��H+��=10-xmol��L-1��c��OH-=10-ymol��L-1��x��y�Ĺ�ϵ��ͼ��ʾ��
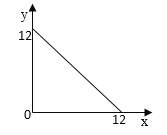
�ٴ��¶��£�0.01mol/L��NaOH��Һ��ˮ�������OH-Ũ��Ϊ_______��
���ڴ��¶��£�0.1mol��L-1��NaHSO4��Һ��0.1mol��L-1��Ba(OH)2��Һ���±��мס��ҡ���������ͬ��ʽ��ϣ�
�� | �� | �� | �� | |
0.1mol��L-1��Ba��OH��2 | 10 | 10 | 10 | 10 |
0.1mol��L-1��NaHSO4 | 5 | 10 | 15 | 20 |
����ʽ��Ϻ�������Һ��pHΪ____________��
���ҷ�ʽ��Ϻ��䷴Ӧ�����ӷ���ʽ��_________________��
������ʽ��Ϻ�������Һ��____________����������������������������