题目内容
【题目】M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)
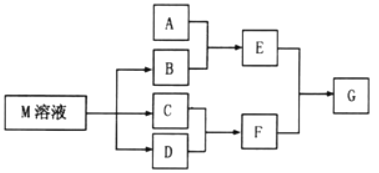
(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为________________________________。
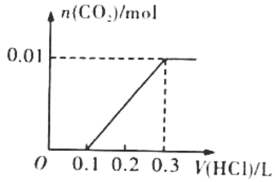
(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如右图所示,则A与B溶液反应后溶液中的溶质为____________________(填化学式),物质的量之比为_______。
(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入KSCN后溶液显红色,则由A转化成E的离子方程式是____________________________________________________。
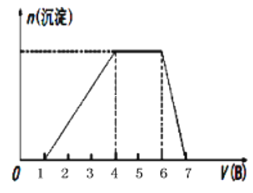
(5)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生如右图所示变化,由此可知,该溶液中肯定含有的离子为______________________________。
【答案】2:3或者2:7 Na2CO3和NaHCO3 1:1 (NH4)2SO3 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓或者分步写Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3) H+、NH4+、Al3+、SO42-
【解析】
已知C可在D中燃烧发出苍白色火焰,所以C为氢气;D为氯气;若A是地売中含量最多的金属元素,则A为铝;AlCl3溶液和氢氧化钠溶液等体积混合后,可能发生的反应有Al3++3OH﹣= Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+H2O,所以生成偏铝酸钠的总反应为Al3++4OH﹣= AlO2﹣+2H2O。若A是CO2气体,A与B溶液反应即CO2+2NaOH=Na2CO3+H2O 、Na2CO3+HCl= NaHCO3+ NaCl、 NaHCO3+HCl= NaCl+H2O+ CO2![]()
(1)当得到的沉淀物中A元素与溶液中A元素的质量相等,由反应的离子方程式可知,碱过量时n[Al(OH)3]=n(AlO2﹣),此时c( AlCl3):c(NaOH)=2:7当碱量不足时,n[Al(OH)3]=n(AlCl3) ,此时c( AlCl3):c(NaOH)=2:3所以A的氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为2:3或2:7。
(2)图所示知0![]() 0.1V盐酸时没有气体放出,发生的是Na2CO3+HCl= NaHCO3+ NaCl ;0.1
0.1V盐酸时没有气体放出,发生的是Na2CO3+HCl= NaHCO3+ NaCl ;0.1![]() 0.3V时气体完全放出,发生的是NaHCO3+HCl= NaCl+H2O+ CO2
0.3V时气体完全放出,发生的是NaHCO3+HCl= NaCl+H2O+ CO2![]() ,所以A与B溶液反应后溶液中的溶质为Na2CO3和NaHCO3,根据消耗盐酸的体积知Na2CO3和NaHCO3物质的量之比为1:1。答案:Na2CO3和NaHCO3、1:1。
,所以A与B溶液反应后溶液中的溶质为Na2CO3和NaHCO3,根据消耗盐酸的体积知Na2CO3和NaHCO3物质的量之比为1:1。答案:Na2CO3和NaHCO3、1:1。
(3)因为B为NaOH,A是一种正盐能和NaOH生成具有刺激性气味的气体,则A中含有NH4+;因为F为HCl,A是一种正盐且A能与大dddHCl生成具有刺激性气味的气体,则A中含有SO32_;所以A为(NH4)2SO3。答案:(NH4)2SO3。
(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入KSCN后溶液显红色,推断出A为亚铁盐溶液,E为Fe(OH)3,则由A转化成E的离子方程式是Fe2++8OH-+O2+2H2O=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)。
(5)由图可以知道,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-= NH3![]() H2O的反应,则含有NH4+,由电荷守恒可以知道一定含有SO42-,由此可知,该溶液中肯定含有的离子为H+、NH4+、Al3+、SO42-。
H2O的反应,则含有NH4+,由电荷守恒可以知道一定含有SO42-,由此可知,该溶液中肯定含有的离子为H+、NH4+、Al3+、SO42-。

【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。


