题目内容
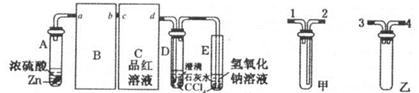
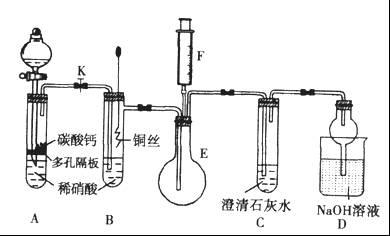
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。根据要求回答下列问题:
(1)用Ⅰ装置做实验时,实验过程中由于观察到烧瓶内有 现象,而不能有力证明反应产物是NO;收集NO能否用瓶口向上排空气法?答: (填“能”“否”)。
(2)用Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到 为止。
a.刚好浸没铜丝下端 b.刚好浸没铜丝中部 c. 单孔塞下沿与液面间不留有空隙
②关闭活塞,用酒精灯对U形管的A侧加热,当 时,撤去酒精灯。
(3)在(2)的实验中:
①什么情况下反应自动停止? 。
何处观察到无色的NO气体? 。
②如果再将分液漏斗的活塞慢慢打开,可在分液漏斗中观察到哪些明显现象?
答: 。
(1)烧瓶内有红棕色气体(2分) 否(2分)
(2)①C (3分) ②铜丝上有气泡产生(3分)
(3)①铜丝网与稀HNO3脱离后(2分) 在U型管A侧管中(2分)
②有红棕色气体出现(2分)
解析试题分析:(1)NO2可与水反应生成NO,为无色气体,烧瓶内有空气,与生成的NO很快被氧化为红棕色的NO2,不易观察到有无色的NO生成,答案:烧瓶内有红棕色气体;否
(2)①实验时应将装置内的空气完全排除,则应单孔塞下沿与液面间不留有空隙,否则不能观察到无色气体,
答案为:C 单孔塞下沿与液面间不留有空隙;
②铜丝与稀硝酸的反应为放热反应,当生成气体时可停止解热,反应放出的热量可维持反应继续进行,
答案为:铜丝上有气泡产生;
(3)①当铜丝和稀硝酸不接触时,反应会自动停止,在左侧可观察到无色气体,
答案为:当产生的NO气体将稀硝酸排入U型管B侧管内使铜丝网与稀硝酸脱离后反应会立即停止;在U型管A侧管内可观察到无色的NO气体;
②如果再将分液漏斗的活塞慢慢打开,右侧压强大于左侧,U型管B侧管中硝酸又回落到A侧管内,NO与空气接触而生成红棕色气体.
答案为:U型管B侧管中硝酸又回落到A侧管内,分液漏斗中有红棕色气体出现.
考点:氮及其化合物的性质

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。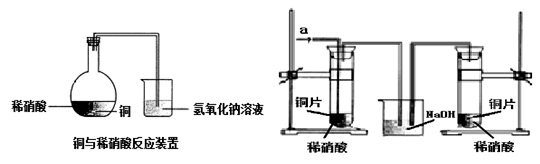
图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂: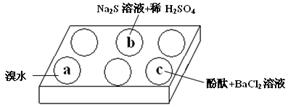
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有 性。
② b中发生反应的离子方程式是 。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述) 。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: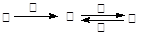 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是氨水 |
| C.若甲为Fe,则丁可能是盐酸 |
| D.若甲为NaOH溶液,则丁可能是CO2 |
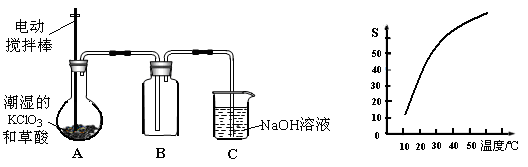
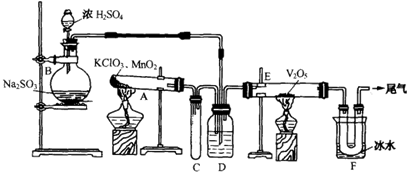
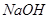 溶液的作用是________________。
溶液的作用是________________。