题目内容
某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂: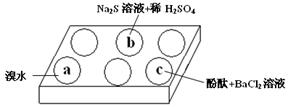
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有 性。
② b中发生反应的离子方程式是 。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述) 。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
(10分)
(1)①还原性 (2分)
②SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O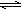 HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①AC (2分)
②11.2 (2分)
解析试题分析:(1)①SO2+Br2+2H2O=H2SO4+2HBr,SO2中S化合价升高,被氧化,显还原性,答案:还原性 (2分)
②酸性条件下,+4价的S和-2价的S反应,生成0价的S,故有淡黄色沉淀,答案:SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③SO32―是弱酸根离子,水解后呈碱性,加Ba2+水解平衡被破坏;答案:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O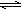 HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①A正确,溶液中存在电荷守恒,B不正确,c(SO32-) > c(HSO3-),C、正确,n(SO32—): n(HSO3—)= 91:9时,pH=8.2,溶液呈碱性,c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+),正确。故答案:AC (2分)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2的体积,令n(SO32-)=3x,则由Na+ 守恒得:3x×2+2x=0.8mol,x=0.1mol,n(SO2)=0.5mol,v(SO2 )=0.5mol×22.4l·mol-1=11.2L,答案:11.2 (2分)
考点:元素及其化合物性质与化学实验、化学反应原理综合。

甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:
下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。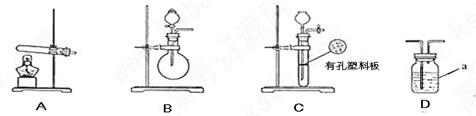
实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙.硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水.氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
(4) 在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(5) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
A.分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
下列反应现象“先变红后褪色”的是
| A.SO2与紫色石蕊溶液 | B.过量的Cl2与KI淀粉溶液 |
| C.硫化氢与醋酸铅试纸 | D.Na2O2与酚酞溶液 |

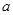 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________ 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。