题目内容
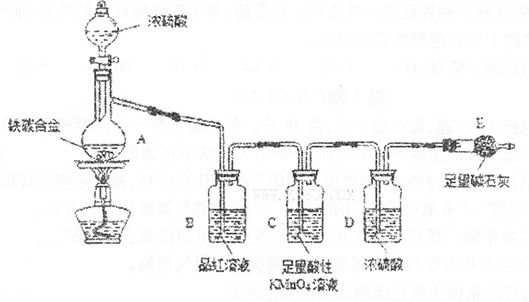
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。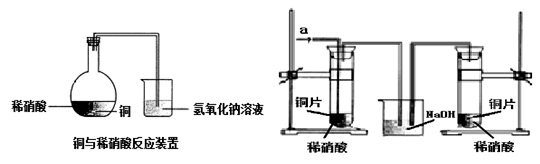
图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
(1)3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O (2分)
NO + NO2 + 2OH?=2NO2? + H2O(2分)
(2)Ⅰ.温度计 (2分) 温度不是速率明显加快的主要原因(2分)
Ⅱ.A(2分) Ⅲ.NO2(2分)
(3) 加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化)(2分)
解析试题分析:(1)硝酸具有强氧化性,稀硝酸的还原产物是NO,所以图1中铜与稀硝酸反应的离子方程式为3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O。反应中液面上方的气体颜色也在不断加深,这是由于NO被氧化生成了红棕色的NO2。不论是NO还是NO2都是大气污染物,需要尾气处理,所以氢氧化钠溶液的作用是吸收NO和NO2,防止污染空气,反应的离子方程式为NO + NO2 + 2OH?=2NO2? + H2O。
(2)I、如果是因为反应放热导致溶液温度升高所致,则必须测量溶液的温度,因此完成此实验还需要的仪器是温度计。根据表中数据可知,80min内溶液的温度只上升了2℃,这说明随着反应的进行,溶液的温度变化不明显,因此温度不是速率明显加快的主要原因。
Ⅱ、为验证铜离子是否有催化作用,作对比实验,在一支试管中加入含有铜离子的盐,一支试管中不加铜盐,然后比较反应速率,根据反应速率大小确定假设是否正确。为防止阴离子对实验的干扰,最好选择硝酸铜晶体,答案选A。
Ⅲ、根据液面上方的气体颜色也在不断加深可推断反应过程中还有少量NO2生成。
(3)如果试管中溶液呈绿色,而不显蓝色。是由于NO2引起的,则可以将将绿色的混合溶液加热,若能放出红棕色气体、且溶液变蓝色,说明这个假设正确或将NO2气体通入蓝色硝酸铜溶液中观察溶液颜色是否变绿色。
考点:考查铜与稀硝酸反应原理的实验探究、实验方案设计与评价等

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(2)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2
 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱
(4)实验开始时,必须先通入X气体,再加热反应物,其理由是______________________________,当反应开始后,移走酒精灯反应能继续进行,其原因是___________________________。
(5)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为_______________________________________。
(16分)硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式 ;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是 ;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
| | 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) |
| 猜想② | ,将试纸与标准比色卡对照 [来源:学*科*网Z*X*X*K] | 溶液pH=8 | |
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | | 2S2O32- +2H+══ S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | |
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由: 。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是: 。
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究。
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中____________ _____,证明 。
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,…… | |
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
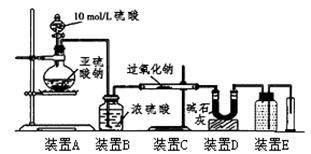
①装置D的作用是 。
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 | |
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: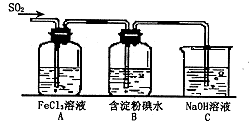
(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是( )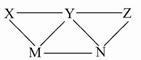
| A.X一定为KHSO4 | B.Y一定为Na2CO3 |
| C.Z可能是氯水 | D.M、N必定各为BaCl2、FeSO4中的一种 |