题目内容
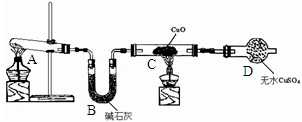
下图是一个制取氯气并以氯气为原料进行特定反应的装置: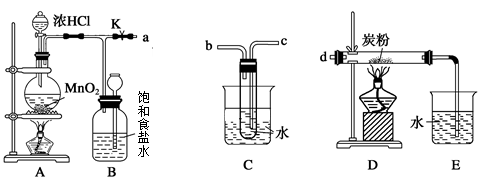
(几种气体的溶解度:常温常压下,1体积水可溶解CO2、Cl2、HCl分别为1、2、500体积)
(1)A是氯气发生装置,其中的离子反应方程式为 ;
(2)要将C装置接入B和D之间,正确的接法是a→______,______ →d。
(3)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为两种气体,且体积比为1∶4。试写出D中发生反应的化学方程式 ,装置C的作用是 ;为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是
。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的
装置图 。
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 。
(1)4H++2Cl-+MnO2 ="==" Mn2++2H2O+Cl2↑
(2)c b(1分)
(3)2Cl2+2H2O(g)+C ="==" 4HCl +CO2
吸收Cl2中的HCl气体,提供D处所需水蒸气;
浓硫酸稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解。(1分)
(4)尾气的吸收需要改进,否则容易出现因为HCl气体的极易溶解导致倒吸现象的出现;
防倒吸装置均可,图略。
(5)瓶中液面下降,长颈漏斗内液面上升。
解析试题分析:(2)C装置是洗气装置,应长导管进气,短导管出气。
(3)C中盛放的水,可以吸收随氯气挥发出的HCl,但同时也会有水蒸气混入Cl2中,因此和碳单质反应时,水蒸气也会参与,根据原子守恒,产生的气体只能是HCl和CO2,。根据产物的体积之比,可写出方程式。
C有提供反应所需水蒸气的作用,加入的浓硫酸在稀释时会放出大量热,可促进试管中水的蒸发,同时可减少氯气的溶解。
(4)尾气中含有易溶于水的HCl,直接通入水中易发生倒吸,因此应改为防倒吸装置。
(5)关闭K后,多余的氯气进入B中,使B中压强增大,因此B中液面下降,长颈漏斗中液面上升。
考点:考查实验原理,实验装置的组装和作用, 方程式的书写,装置的改进等。

某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究。
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中____________ _____,证明 。
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,…… | |
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
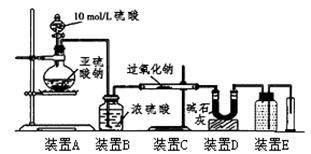
①装置D的作用是 。
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 | |
甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:
下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。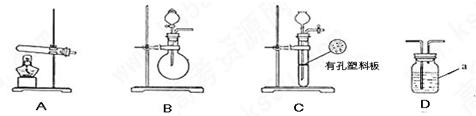
实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙.硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水.氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: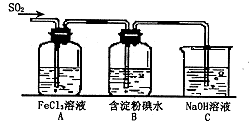
(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。