题目内容
5.有以下物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2.请用上述物质的数字序号填空:(1)只存在离子键的是⑨
(2)既存在离子键又存在极性键的是②③④
(3)不存在化学键的是①
(4)属于共价化合物的是⑥⑦.
分析 金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,以此解答该题.
解答 解:①Ne为单质,不存在化学键;
②NH4Cl为离子化合物,含有离子键和极性共价键;
③KNO3为离子化合物,含有离子键和极性共价键;
④NaOH为离子化合物,含有离子键和极性共价键;
⑤Cl2为单质,只含有共价键;
⑥SO2属于共价化合物,含有共价键;
⑦H2S属于共价化合物,含有共价键;
⑧Na2O2为离子化合物,含有离子键和非极性共价键;
⑨MgCl2为离子化合物,只含有离子键.
(1)只存在离子键的是⑨,故答案为:⑨;
(2)既存在离子键又存在极性键的是②③④,故答案为:②③④;
(3)不存在化学键的是①,故答案为:①;
(4)属于共价化合物的是⑥⑦,故答案为:⑥⑦.
点评 本题考查了化学键的判断,注意离子键和共价键的区别,易错点是①,注意稀有气体是单原子分子,所以不含化学键,为易错点.

练习册系列答案
相关题目
13.常温下下列关系的表述中,正确的是( )
| A. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| B. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
20.下列可设计成原电池的化学反应是( )
| A. | H2O (l)+CaO(s)═Ca(OH)2(s) | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O | |
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | |
| D. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l) |
17.下列分子中既含有极性键又含有非极性键且为极性分子的是( )
| A. | CS2 | B. | CH4 | C. | CH3CH2Cl | D. | CH≡CH |
15.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
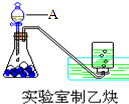 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑. ;
; .
.