题目内容
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。下列说法错误的( )
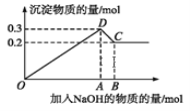
A.C点溶液中溶质为偏铝酸钠和氯化钠
B.原溶液中Mg2+、Al3+的物质的量浓度之比为 2∶1
C.C点加入0.8mol NaOH
D.图中线段OA∶AB=5∶1
【答案】D
【解析】
A.由图象可知,0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,A~B发生Al(OH)3+OH-═AlO2-+2H2O,则C点对应的沉淀为Mg(OH)2,溶液中的溶质为NaAlO2和NaCl,故A正确;
B.C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,则原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1,故B正确;
C.由选项B的解析可知:Mg2+的物质的量为0.2mol、Al3+的物质的量为0.1mol,则溶液中Cl-为0.2mol×2+0.1mol×3=0.7mol,C点对应溶液中的溶质为NaAlO2和NaCl,则n(Na+)=0.1mol+0.7mol=0.8mol,即C点加入0.8mol NaOH,故C正确;
D.0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;A~B发生Al(OH)3+OH-═AlO2-+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,故线段OA:AB=0.7mol:0.1mol=7:1,故D错误;
故答案为D。

【题目】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号 | 操作 | 现象 |
ⅰ | 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 | 产生红褐色沉淀 |
ⅱ | 取2 mL溶液X,加入1滴KSCN | 溶液显红色 |
(1)请用文字表述做出假设b的依据是__________________________。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)_____、_____。
(3)由实验ⅱ得出的结论是____________。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是_____________________________。为进一步验证假设,小组同学进行了以下实验:
实验序号 | 操作 | 现象 |
ⅲ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
ⅳ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水 | 溶液显红色,颜色比ⅲ深 |
(4)实验ⅳ中氯水参加反应的离子方程式是_______________________。
(5)通过以上实验,可得到的结论是_____________________________,请完整表达该结论是如何得出的_______________________________。


