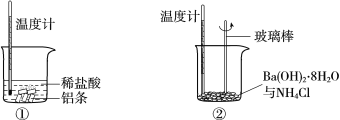
题目内容
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
【答案】C
【解析】
分析浓度商与平衡常数的相对大小,判断反应进行的方向及是否为平衡状态。
一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,该反应的浓度商Qc
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,该反应的浓度商Qc![]() 4>K,则该反应向逆反应方向进行。
4>K,则该反应向逆反应方向进行。
A. 该反应没有达到平衡状态,正逆反应速率不相等,A不正确;
B. 化学平衡常数只与温度有关,改变反应的温度才能改变平衡常数 ,若改变其他条件,则平衡常数不变,故改变条件后,化学平衡常数不一定改变,B不正确;
C. Qc![]() 4>K,反应逆向进行,正反应速率小于逆反应速率,C正确;
4>K,反应逆向进行,正反应速率小于逆反应速率,C正确;
D. 该反应ΔH>0,故升高温度平衡正向移动,D不正确。
综上所述,说法正确的是C。

【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___;
(2)元素①的单质电子式为____。
(3)比较③、⑤元素的金属性强弱___>___;并写出它们最高价氧化物对应的水化物间反应的化学方程式____。
(4)上述元素的最高价氧化物对应的水化物中,酸性最强的是____。
(5)在元素③、④、⑤、⑦、⑧形成的简单离子中,半径最小的是_____;
(6)工业制取⑥的单质的反应的化学方程式为_______。
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是________________________span>;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为____________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
II.100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
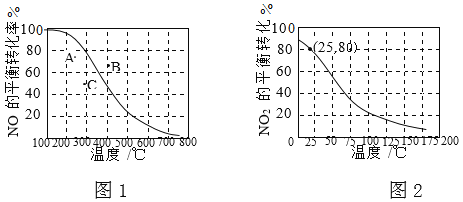
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)