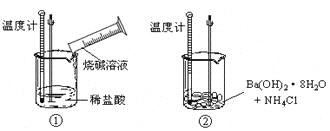
题目内容
【题目】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号 | 操作 | 现象 |
ⅰ | 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 | 产生红褐色沉淀 |
ⅱ | 取2 mL溶液X,加入1滴KSCN | 溶液显红色 |
(1)请用文字表述做出假设b的依据是__________________________。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)_____、_____。
(3)由实验ⅱ得出的结论是____________。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是_____________________________。为进一步验证假设,小组同学进行了以下实验:
实验序号 | 操作 | 现象 |
ⅲ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
ⅳ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水 | 溶液显红色,颜色比ⅲ深 |
(4)实验ⅳ中氯水参加反应的离子方程式是_______________________。
(5)通过以上实验,可得到的结论是_____________________________,请完整表达该结论是如何得出的_______________________________。
【答案】FeSO4具有还原性,露置在空气中,容易被氧气氧化为Fe2(SO4)3 ![]()
![]() 化肥中肯定有Fe2(SO4)3(假设a不成立) 溶液中存在Fe3+,遇NaOH产生红褐色沉淀,因此看不到Fe2+与NaOH反应生成沉淀的颜色变化(现象被遮盖等)或Fe2+已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象
化肥中肯定有Fe2(SO4)3(假设a不成立) 溶液中存在Fe3+,遇NaOH产生红褐色沉淀,因此看不到Fe2+与NaOH反应生成沉淀的颜色变化(现象被遮盖等)或Fe2+已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象 ![]() 化肥成分含有FeSO4和Fe2(SO4)3(假设b成立) 实验ⅲ证明了溶液中有Fe3+;实验ⅳ中加入氯水后溶液颜色变深,说明Fe3+增加,证明原溶液中有Fe2+,所以溶液中既有Fe3+,也有Fe2+,即假设b成立
化肥成分含有FeSO4和Fe2(SO4)3(假设b成立) 实验ⅲ证明了溶液中有Fe3+;实验ⅳ中加入氯水后溶液颜色变深,说明Fe3+增加,证明原溶液中有Fe2+,所以溶液中既有Fe3+,也有Fe2+,即假设b成立
【解析】
(1)FeSO4具有还原性,易被氧气氧化为Fe2(SO4),据此分析;
(2)根据白色沉淀、变为灰绿色、最后出现红褐色沉淀的现象可推断出该反应为氢氧化亚铁转化为氢氧化铁的反应,据此解答;
(3)滴加KSCN溶液显红色,可推断含有Fe2(SO4)3;实验ⅰ实际现象与预期现象不符的原因可能为溶液中的Fe3+遇NaOH产生红褐色沉淀,红褐色沉淀遮盖了白色的氢氧化亚铁沉淀,也可能为Fe2+已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象,据此解答;
(4)氯水中氯气氧化了亚铁离子,据此写出离子反应式;
(5) 由实验现象可推知化肥成分含有FeSO4和Fe2(SO4)3(假设b成立);实验ⅳ:溶液X中加入1滴KSCN,再加入1 mL氯水,颜色比ⅲ深,说明含有Fe2+,且Fe2+被氯水氧化为Fe3+,实验ⅲ,溶液X,加入1滴KSCN,再加入1 mL水,溶液显红色,说明含有Fe3+,综合实验ⅲ、ⅳ得出结论;
(1)做出假设b的依据是FeSO4具有还原性,露置在空气中,容易被氧气氧化为Fe2(SO4)3;
故答案为:FeSO4具有还原性,露置在空气中,容易被氧气氧化为Fe2(SO4)3;
(2)根据实验ⅰ的预期现象,白色沉淀、变为灰绿色、最后出现红褐色沉淀可知相应的方程式为![]() ,
,![]() ;
;
故答案为:![]() ;
;![]() ;
;
(3) 由实验ⅱ的现象溶液变红色可得出的结论,化肥中肯定有Fe2(SO4)3(假设a不成立); 根据实验现象,推测实验ⅰ实际现象与预期现象不符的原因可能为溶液中存在Fe3+,遇NaOH产生红褐色沉淀,因此看不到Fe2+与NaOH反应生成沉淀的颜色变化(现象被遮盖等)或![]() 已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象;
已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象;
故答案为:化肥中肯定有Fe2(SO4)3(假设a不成立);溶液中存在Fe3+,遇NaOH产生红褐色沉淀,因此看不到Fe2+与NaOH反应生成沉淀的颜色变化(现象被遮盖等)或Fe2+已全部被氧化为Fe3+,溶液中无Fe2+,因此看不到预期现象;
(4) 实验ⅳ中氯水参加反应的离子方程式是![]() ;
;
故答案为:![]() ;
;
(5) 由实验现象可推知化肥成分含有FeSO4和Fe2(SO4)3(假设b成立);实验ⅲ证明了溶液中有Fe3+;实验ⅳ中加入氯水后溶液颜色变深,说明Fe3+增加,证明原溶液中有Fe2+,所以溶液中既有Fe3+,也有Fe2+,即假设b成立;
故答案为:化肥成分含有FeSO4和Fe2(SO4)3(假设b成立);实验ⅲ证明了溶液中有Fe3+;实验ⅳ中加入氯水后溶液颜色变深,说明![]() 增加,证明原溶液中有Fe2+,所以溶液中既有
增加,证明原溶液中有Fe2+,所以溶液中既有![]() ,也有Fe2+,即假设b成立;
,也有Fe2+,即假设b成立;

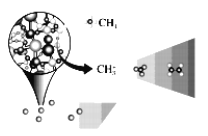
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
物质 | 燃烧热/(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应,器中充入1 mol CH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:
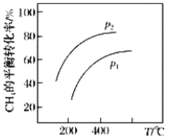
①在该温度下,其平衡常数KC=____________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率____________。(填“增大”“减小”“不变”或“无法确定”),理由是_______________________________。
③若反应器的体积固定,不同压强下可得变化如右图所示,则压强P1,P2的大小关系是____________。
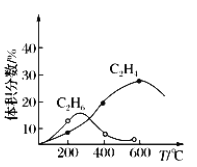
(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式________________________________________________。