题目内容
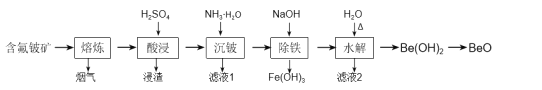
【题目】铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为___。
(2)浸渣的主要成分为CaSO4、___。
(3)加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:___、___、___。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为___,然后加适量水稀释进行“水解”,目的是___。
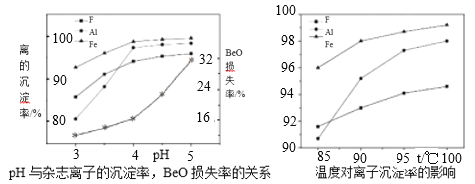
(5)若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=___,水浴加热温度T=___℃。
(6)氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:__。
【答案】Al2O3+3CaF2![]() 2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀释使溶液的碱性变弱,BeO22-水解,分离除去沉淀中的铝元素 4 95 K=
2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀释使溶液的碱性变弱,BeO22-水解,分离除去沉淀中的铝元素 4 95 K=![]() =
= =2.9×103,K值很大,说明转化反应程度很大
=2.9×103,K值很大,说明转化反应程度很大
【解析】
含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)经过熔炼,发生反应Al2O3+3CaF2![]() 2AlF3↑+3CaO,“熔炼”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,则“酸浸”除去二氧化硅等,“酸浸”后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,“沉铍”后Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氢氧化钠后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氢氧化铁,最后加适量的水稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2水解得到氢氧化铍。
2AlF3↑+3CaO,“熔炼”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,则“酸浸”除去二氧化硅等,“酸浸”后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,“沉铍”后Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氢氧化钠后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氢氧化铁,最后加适量的水稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2水解得到氢氧化铍。
(1)根据元素守恒分析,Al2O3转化为烟气AlF3,应为Al2O3与CaF2发生复分解反应:Al2O3+3CaF2![]() 2AlF3↑+3CaO。
2AlF3↑+3CaO。
(2)“熔炼”后适当冷却加入硫酸进行“酸浸”,主要是含氟铍矿中各种氧化物BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,故浸渣的主要成分为CaSO4、SiO2。
(3)酸浸后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,加入氨水中和酸浸液,pH调至8~9时,Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,因Fe(OH)3不与氢氧化钠反应,Be(OH)2、Al(OH)3性质相似为两性氢氧化物能与氢氧化钠溶液反应,发生Be(OH)2+2OH-=BeO22-+H2O、Al(OH)3+OH-=AlO2-+2 H2O,将Fe(OH)3分离,溶液中阴离子主要是BeO22-、AlO2-,后加适量水稀释进行“水解”,根据流程中的得到的信息“水解”目的是得到Be(OH)2,故说明流程中加适量的水是稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2,分离除去沉淀中的铝元素。
(5)若为高氟铍矿则“酸浸”后溶液中含有大量的氟离子,氟离子浓度偏大会与Be2+形成配合物溶于水而增加了铍的损失率,因此需在“沉铍”前进行“除氟。根据题目信息工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。图1明显在pH=4时F、Al、Fe的沉淀率高,但pH高于4时,铍的损失率增大,故实验条件为pH=4,由图2看出温度在95℃后杂质离子的除去率高,故水浴加热温度为95℃。
(6)反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)的K=![]() =
= =2.9×103,因为K值很大,说明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反应程度很大。
=2.9×103,因为K值很大,说明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反应程度很大。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。