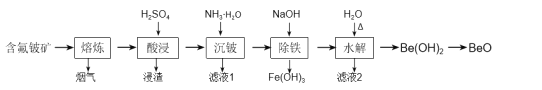
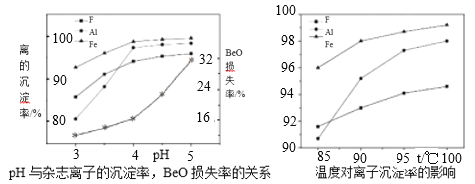
题目内容
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:

(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
【答案】A点的导电率高 Ba(OH)2 = Ba2+ + 2OH- H+ + OH-= H2O Ba2+、Cl- BC
【解析】
溶液的导电率和离子浓度有关系,和离子所带电荷也有关系。 A→B段,H+和OH-反应生成H2O,溶液中离子浓度减小;B→C段,随着盐酸的加入,溶液中离子浓度增大,溶液导电率增高;因此可以推出B点时,Ba(OH)2和HCl恰好完全反应。
(1)A→B段,A点的溶液导电率高,随着盐酸的量的增多,溶液的导电率减小,是因为发生反应H++OH-=H2O,溶液中离子浓度减小,说明Ba(OH)2在水中以离子形式存在;Ba(OH)2的电离方程式为:Ba(OH)2 =Ba2++2OH-;
(2)A-B段,Ba(OH)2和HCl发生反应,离子方程式为:H+ +OH-=H2O;
(3)B点,Ba(OH)2和HCl恰好完全反应,此时溶液中存在的微粒有H2O、Ba2+、Cl-;
(4)Ba(OH)2溶液与稀盐酸反应的实质是:H+ +OH-=H2O;
A、Ba(OH)2和H2SO4反应的实质是:2H+ +SO42-+Ba2++2OH-=BaSO4↓+2H2O;
B、NaOH和H2SO4反应的实质是:H+ +OH-=H2O;
C、Ba(OH)2与HNO3反应的实质是:H+ +OH-=H2O;
则B、C符合题意,故选BC。

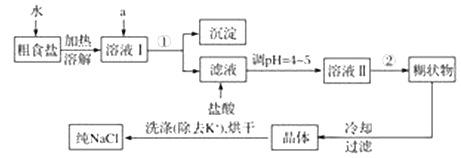
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是

有关数据如下表所示:
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
A.该电池的正极反应式为MnO2+eˉ+H+=MnOOH
B.利用干电池,高温电解H2O–CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法