题目内容
9.下列变化中,不需要破坏化学键的是( )| A. | 氯化氢溶于水 | B. | 加热氯酸钾使其分解 | ||
| C. | 干冰升华 | D. | 二氧化硅熔化 |
分析 发生化学反应时物质中的化学键被破坏,熔化及电离过程中化学键也被破坏,以此来分析.
解答 解:A.氯化氢溶于水时H-Cl共价键被破坏,故A不选;
B.加热氯酸钾,分解生成氧气,发生化学变化,存在化学键的断裂,故B不选;
C.干冰气化需克服分子间作用力,而化学键没有变化,故C选;
D.二氧化硅熔化时需破坏碳碳共价键,故D不选.
故选C.
点评 本题考查化学键,为高频考点,熟悉化学反应中、熔化、电离过程中的化学键变化是解答本题的关键,并注意利用分子间作用力不属于化学键来解答.

练习册系列答案
相关题目
17.下表为周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是( )
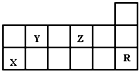

| A. | 热稳定性:Y的气态氢化物<Z的气态氢化物 | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R元素的单质化学性质活泼 |
1.下列对于加成反应的说法中正确的是( )
| A. | 加成反应的结果是使有机化合物中不再含有不饱和键 | |
| B. | 福尔马林可以作为食品保鲜剂 | |
| C. | 甲苯在光照条件下与氯气反应,主要生成2,4-二氯甲苯 | |
| D. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 |
18.下列过程能实现热能转化为化学能的是( )
| A. | HCl十NaOH=NaCl十H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO十H2O=Ca(OH)2 |

 (写结构简式).
(写结构简式). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
