题目内容
11.由2-氯丙烷制得少量的CH2OHCHOHCH3 需要经过下列几步反应( )| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
分析 2-氯丙烷制得少量的CH2OHCHOHCH3,应先生成CH3CH=CH2,然后加成生成CH3CHBrCH2Br,水解可生成CH2OHCHOHCH3,以此解答该题.
解答 解:2-氯丙烷制得少量的CH2OHCHOHCH3,应先发生消去反应生成CH3CH=CH2,然后发生加成反应生成CH3CHBrCH2Br,最后水解可生成CH2OHCHOHCH3,故选B.
点评 本题主要考查有机物的合成,题目难度不大,本题注意根据官能团的变化可解答该题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列装置能够组成原电池的是( )
| A. |  | B. | 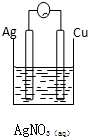 | C. | 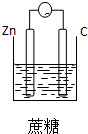 | D. | 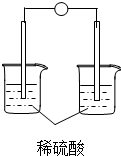 |
2.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有吸水性 | |
| B. | 浓H2SO4和木炭能反应,是利用浓H2SO4的强氧化性 | |
| C. | 浓硫酸可以用于干燥Cl2,是利用浓H2SO4的吸水性 | |
| D. | 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明CuS既难溶于水,也难溶于稀硫酸 |
6.下列关于著名化学家的名字、国籍及主要贡献的对应关系中,不正确的是( )
| 科学家 | 国籍 | 主要贡献 | |
| A | 贝采利乌斯 | 瑞典 | 首先提出“有机化学”和“有机化合物”的概念 |
| B | 维勒 | 德国 | 首次人工合成了有机物--尿素 |
| C | 李比希 | 法国 | 创立了有机物的定量分析方法 |
| D | 门捷列夫 | 俄国 | 发现元素周期律 |
| A. | A | B. | B | C. | C | D. | D |
20.在25℃,101k P的条件下,5.2g C2H2完全燃烧生成CO2和H2O(l)时放出259.92kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
8.某学生小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).

(5)有关数据记录如下:
则该小组计算得到NaOH溶液的物质的量浓度为0.10mol/L.
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).

(5)有关数据记录如下:
| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
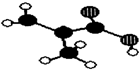 浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).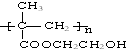 .
.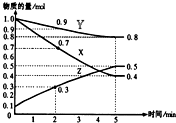 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.