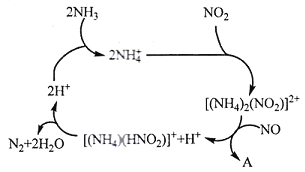
题目内容
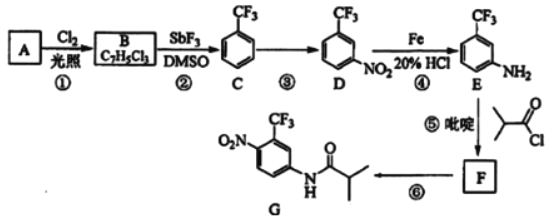
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.除去Cl2中含有的少量HCl 
B.蒸干FeCl3饱和溶液制备FeCl3晶体
C.制取少量纯净的CO2气体
D.分离CCl4萃取碘水后已分层的有机层和水层
【答案】D
【解析】
A.除去Cl2中含有的少量HCl ,Cl2氯化氢均与NaOH溶液反应,无法达到分离提纯的目的,应该选用饱和食盐水,A错误;
B.直接蒸干FeCl3饱和溶液时,铁离子水解生成HCl,蒸干得到Fe(OH)3,灼烧产物为Fe2O3,不能制备FeCl3晶体,B错误;
C.图中是简易的启普发生器装置,适合于不需加热的块状固体与液体反应制备气体,纯碱是白色粉末状物质,易溶于水,使用启普发生器不能控制反应停止,达不到制备少量CO2的目的,C错误;
D.CCl4萃取碘水后的有机层和水层互不相溶,CCl4密度大在下层,水在上层,可用分液漏斗分离,D正确;
故选D。

练习册系列答案
相关题目