题目内容
2.一定温度下,测得某纯水的pH为6.5.试计算:(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol•L-1.的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01molNaSO4的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10].
分析 (1)纯水中,c(H+)=c(OH-),Kw=c(H+).c(OH-);
(2)先计算氢氧根离子浓度,再根据离子积常数计算氢离子浓度,从而计算溶液的PH;
(3)取上述Ba(OH)2溶液200mL,n(BBa2+)=CV=0.005mol•L-1×0.2L=0.001mol,加入含0.01molNa2SO4的浓溶液,发生反应:Ba2++SO42-=BaSO4↓,求出反应后剩余的硫酸根离子浓度,再依据浓度积C(Ba2+)=$\frac{{K}_{sp}}{c(S{{O}_{4}}^{2-})}$计算,注意溶液混合时,体积变化忽略不计.
解答 解:(1)纯水中,c(H+)=c(OH-),Kw=c(H+).c(OH-)=10-13,
答:此时水的离子积常数Kw为10-13;
(2)该溶液中,c(OH-)=2c(Ba(OH)2)=2×0.005mol•L-1=1.0×10-2 mol•L-1,c(H+)=$\frac{1×1{0}^{-13}}{1×1{0}^{-2}}$mol/L=10-11mol/L,所以溶液的pH=11,
答:其溶液的pH为11;
(3)取上述Ba(OH)2溶液200mL,n(Ba2+)=CV=0.005mol•L-1×0.2L=0.001mol,加入含0.01molNa2SO4的浓溶液,发生反应的离子方程式为:Ba2++SO42-=BaSO4↓,
反应后剩余的硫酸根离子浓度为0.01mol-0.001mol=0.0099mol,溶液200mL,C(SO42-)=$\frac{9.9×1{0}^{-3}}{0.2}$=4.95×10-2mol•L-1,Ksp(BaSO4)=1.08×10-10,待反应完全后,上层清液中Ba2+浓度变为c(BBa2+)=$\frac{{K}_{sp}}{c(S{{O}_{4}}^{2-})}$=$\frac{1.08×1{0}^{-10}}{4.95×1{0}^{-2}}$mol•L-1≈2.18×10-9mol•L-1,
答:待反应完全后,上层清液中Ba2+浓度变为2.18×10-9mol•L-1.
点评 本题考查离子积常数、沉淀溶解平衡平衡常数的有关计算,题目难度中等,注意(3)先根据Ba2++SO42-=BaSO4↓,求出反应后剩余的硫酸根离子浓度,再依据浓度积计算,为易错点.

| A. | 液氯 | B. | 漂白粉 | C. | 新制氯水 | D. | 水玻璃 |
| A. | AgCl(Ksp=1.56×10-10) | B. | Ag2CO3(Ksp=8.1×10-12) | ||
| C. | Ag2CrO4(Ksp=9.0×10-12) | D. | AgBr(Ksp=5.0×10-13) |
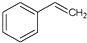 )的下列叙述,正确的是( )
)的下列叙述,正确的是( )| A. | 苯乙烯不可能发生加成反应 | |
| B. | 苯乙烯不可能使酸性高锰酸钾溶液褪色 | |
| C. | 苯乙烯不可能使溴的四氯化碳溶液褪色 | |
| D. | 苯乙烯可通过加聚反应生成高分子化合物 |
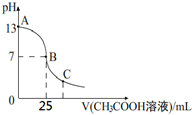 25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )
25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )| A. | A、B间的溶液中可能有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | B点:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) | |
| C. | C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | NaOH溶液和醋酸溶液的浓度都恰好为0.1 mol•L-1 |
| A. | ①②③ | B. | ②③① | C. | ③①② | D. | ②①③ |
| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 向碳酸氢铵溶液中加入过量的稀氢氧化钠溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++H++NH4++2OH-+SO 42-═BaSO4↓+H2O+NH3•H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
| A. | ⑥⑤④①③② | B. | ⑥④⑤②①③ | C. | ⑥④①③⑤② | D. | ②⑥④①③⑤ |



