题目内容
14.下列反应的离子反应方程式书写正确的是( )| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 向碳酸氢铵溶液中加入过量的稀氢氧化钠溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++H++NH4++2OH-+SO 42-═BaSO4↓+H2O+NH3•H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
分析 A.酸性溶液中反应产物中不能存在氢氧根离子;
B.氢氧化钠过量,铵根离子和碳酸氢根离子都完全反应;
C.硫酸氢铵过量,在房产税按照氢氧化钡的化学式书写,氢离子优先反应,铵根离子不参与反应;
D.铁离子具有氧化性,能够将碘离子氧化成碘单质.
解答 解:A.向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液,反应生成碘单质和水,正确的离子方程式为:2I-+2H++H2O2═I2+2H2O,故A错误;
B.向碳酸氢铵溶液中加入过量的稀氢氧化钠溶液,反应生成一水合氨、碳酸钠和水,反应的离子方程式为:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O,故B正确;
C.向Ba(OH)2溶液中加入过量NH4HSO4,则氢离子足量,铵根离子不参与反应,正确的离子方程式为:Ba2++2H++2OH-+SO 42-═BaSO4↓+2H2O,故C错误;
D.Fe2O3溶于过量的氢碘酸中,反应生成亚铁离子和碘单质,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
4.下列有关金属及其化合物的说法正确的是( )
| A. | 铜粉与稀硫酸不反应,但加入一定量硝酸钠后铜粉会发生溶解 | |
| B. | 金属Na久置于空气中最终产物是生成Na2O2 | |
| C. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉有红棕色固体生成 |
5.下列化学式中,能真实表示物质的分子组成的是( )
| A. | CuSO4 | B. | CS2 | C. | Ar | D. | CsCl |
9.下面几组物质,请将合适组号填写在下表中.
①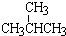 和
和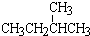 ; ②
; ②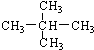 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
①
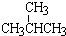 和
和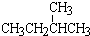 ; ②
; ②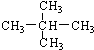 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
6.我国有丰富的天然气资源.以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
变化如下:
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)
4.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
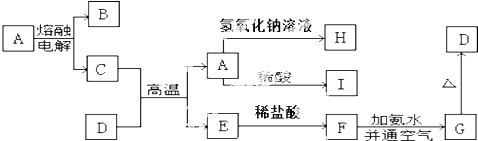
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: