题目内容
12.实验室制备少量硫酸亚铁晶体的实验步骤如下:①趁热过滤 ②洗涤、滤纸吸干 ③静置、冷却④水浴加热⑤抽滤 ⑥过量铁屑,加入20%-30%的稀硫酸溶液.则实验步骤正确的顺序为( )| A. | ⑥⑤④①③② | B. | ⑥④⑤②①③ | C. | ⑥④①③⑤② | D. | ②⑥④①③⑤ |
分析 将过量铁屑,加入20%-30%的稀硫酸溶液,水浴加热控制温度在50~80℃,充分反应后,趁热过滤,将滤液转入到密闭容器中,静置、冷却,抽滤,待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,即可得到硫酸亚铁晶体.
解答 解:首先将过量铁屑,加入20%-30%的稀硫酸溶液,水浴加热控制温度在50~80℃,充分反应后,趁热过滤,将滤液转入到密闭容器中,静置、冷却,抽滤,待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,即可得到硫酸亚铁晶体;
故选C.
点评 本题考查实验室制备少量硫酸亚铁晶体的实验步骤,难度不大,注意操作的先后顺序.

练习册系列答案
相关题目
20.如表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是( )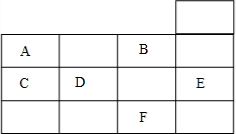

| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
7.下列化学用语表述正确的是( )
| A. | 羟基的电子式: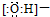 | B. | 硫原子的原子结构示意图: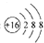 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: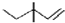 |
17.下列反应原理中,不符合工业冶炼金属实际情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
4.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
1.某草药中有一种色素,它的结构简式为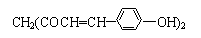 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
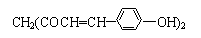 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
9.对于原子半径的理解,不正确的是( )
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: