题目内容
11.下列铜-锌原电池装置中,电极材料、灯泡、烧杯等均相同,能使小灯泡最亮用持续时间最长的是( )| A. |  | B. |  | C. |  | D. |  |
分析 根据影响导电能力的因素,正负极之间的距离越近,电解质溶液的离子浓度越大,导电能力越强,据此分析.
解答 解:因为正负极之间的距离越近,电解质溶液的离子浓度越大,导电能力越强,所以C正负极之间的距离最近,电解质溶液的离子浓度最大,所以使小灯泡最亮用持续时间最长的是C,故选:C.
点评 本题主要考查了影响导电能力的因素,难度不大,抓住正负极之间的距离越近,电解质溶液的离子浓度越大,导电能力越强即可解题.

练习册系列答案
相关题目
1.有一种新合成的烷烃称立方烷,它的结构如图:有关说法正确的是( )


| A. | 它的分子式为C8H10 | B. | 与苯乙烯是同分异构体 | ||
| C. | 能发生加成反应 | D. | 它的二氯代物共有4种 |
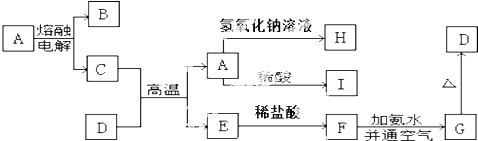
6.我国有丰富的天然气资源.以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
变化如下:
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)
20.如表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是( )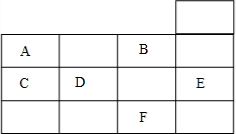

| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
1.某草药中有一种色素,它的结构简式为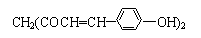 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
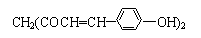 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: