题目内容
【题目】中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1
2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)![]()
C(g)+D(g) △H>0的化学平衡,时间速率图像如右图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
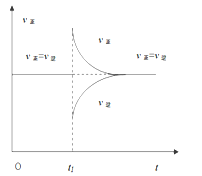
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。

(6)在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:
【答案】Ⅰ.(1)C(s)+H2O(g)![]() CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2(g) △H= +131.3 kJmol-1
(2)CO32- + H2S = HCO3-+ HS- (3)< < (4)A Ⅱ.(5)1:1 (6)N2O、NO2
【解析】
试题分析:Ⅰ.(1)H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1 ①、2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1 ②,利用盖斯定律将方程式变形:②÷2-①得 C(s)+H2O(g)=H2(g)+CO(g)△H= +131.3 kJmol-1 ;
(2)由于Ka2=7.1×10-15<Ka1=1.3×10-7<Ka1=4.4×10-7、Ka2=4.7×10-11>Ka2=1.3×10-7,所以氢硫酸能够与碳酸钠溶液反应生成碳酸氢钠和硫氢化钠,反应的离子方程式为CO32- + H2S = HCO3-+ HS-;(3)根据表格提供的信息,CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
650℃时,初始浓度 2mol/L 1mol/L 0 0
转化浓度 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
平衡浓度 1.2mol/L 0.2mol/L 0.8mol/l 0.8mol/l
所以平衡常数K=(0.8×0.8)÷(0.2×1.2)=2.67
900℃时 CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 1mol/L 0.5mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.8mol/L 0.3mol/L 0.2mol/l 0.2mol/l
平衡常数K=(0.2×0.2)÷(0.8×0.3)=0.167
温度升高,K值减小,说明平衡逆向移动,则该反应为放热反应,ΔH < 0。
若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时Q=(1×2.5)÷(2.5×5)= 0.2>0.17,这说明反应向逆反应方向进行,因此υ正<υ逆。
(4)由图像可知,正反应速率增大,逆反应速率减小,再次达到平衡时,正逆反应速率相等且与原平衡速率相等,A.减小压强,V(正)、V(逆)同时减小,该反应是气体体积不发生变化的可逆反应,平衡不移动,升高温度,V (正)、V (逆)同时增大,正反应速率增幅大于逆反应速率,平衡正向移动,A项正确;B.增加B(g)浓度,V(正)增大,降低C(g)浓度,V (逆)减小,平衡向正反应方向移动,B项错误;C.增加A(g)浓度,V (正)增大,V (逆)不变,降低温度,V (正)、V (逆)均减小,V (正)减小的多,平衡移动方向取决于谁的影响为主,C项错误;D.保持容器温度压强不变通入稀有气体,相当于减小压强,平衡不移动,但V(正)、V(逆)反应速率均减小,D项错误;答案选A。
Ⅱ.(5)1×104L(标准状况下)尾气中含NOx的体积为:1×104L×1.12% = 112L,NOx的物质的量为:112L÷22.4L/mol=5mol。设NO和NO2的物质的量分别为x、y mol,根据反应化学方程式①和②:
① CH4(g) + 4NO2(g) ![]() 4NO(g) + CO2(g)+2H2O(g)
4NO(g) + CO2(g)+2H2O(g)
16g 4 4
m1 y y m1 = 4y
② CH4(g) + 4NO(g)![]() 2N2(g) +span> CO2(g)+2H2O(g)
2N2(g) +span> CO2(g)+2H2O(g)
16g 4
m2 (x+y) m2 = 4(x+y)
则: x+y = 5;4(x+y)+ 4y = 30,解得:x =2.5 mol = 2.5 mol,尾气中V(NO)︰V(NO2) = 1:1 。
(6)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案