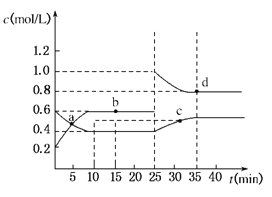
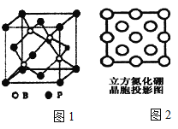
��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ������Ԫ�ط��Ż�ѧʽ�ش��������⡣
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
��1��д��������Ԫ����ɵķ��ӵĵ���ʽ��_______��
��2��������̬�⻯���������������ˮ���ﷴӦ�ķ���ʽΪ , ���������г���Ԫ���������Ӱ뾶��С���� �������ӷ��ţ���
��3���ڢۢ�����Ԫ������������Ӧ��ˮ���������ǿ���� (�ѧʽ)��Ԫ�������⻯��ĽṹʽΪ �� ���⻯���Ԫ�������ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ�����ĵ������ڢ��γɵĻ��������Һ��Ӧ�����ӷ���ʽΪ ���ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ ��
��5������ͬ���壬�������ڵ�Ԫ�ص��������ĵ�����ȼ�����ɵĻ�����ĵ���ʽ ���ܢ��Ԫ�ص����ӵĻ�ԭ����ǿ����˳��Ϊ �������ӷ��ţ���
���𰸡���1��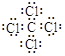 ��2��NH3+ HNO3= NH4NO3Al3+
��2��NH3+ HNO3= NH4NO3Al3+
��3��KOH H��O��H 2F2+ 2H2O =" 4HF" + O2
��4��Cl2+2Br����2 Cl��+Br2 ��Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ���²�Ϊ��ɫ
��5��![]() Br����Cl����F��
Br����Cl����F��
���������������������Ԫ�������ڱ��е�λ�ÿ�֪��������Ԫ�طֱ�ΪN��K��Mg��F��Al��C��O��Cl��Br��Ar��
��1�����������������������ֱ�ΪC��Cl�γɹ��ۻ�����CCl4������ʽΪ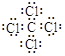 ��
��
��2��������̬�⻯��ΪNH3��N������������ˮ����ΪHNO3�����߷�Ӧ��������泥���Ӧ�ķ���ʽΪNH3+ HNO3= NH4NO3, ͬ����Ԫ�ص������ӵĵ��Ӳ�������������ͬ�������ӵĵ��Ӳ����뱾������ͬ���ҵ��Ӳ�����ͬ�����ӣ��˵����Խ�뾶ԽС������������г���Ԫ���������Ӱ뾶��С����Al3����
��3���ڢۢ�Ԫ�طֱ�ΪK��Mg��Al��Ԫ�صĽ�����Խǿ������������ˮ�������Խǿ�������ԣ�K>Mg>Al������Ԫ������������Ӧ��ˮ���������ǿ����KOH��Ԫ�������⻯��ΪH2O��ˮ�ǹ��ۻ����ˮ�ĽṹʽΪH��O��H�� ˮ��F2���ҷ�Ӧ����HF����������Ӧ�Ļ�ѧ����ʽΪ2F2+ 2H2O =" 4HF" + O2��
��4��Ԫ�����ĵ������������ڢ��γɵĻ�����ΪKBr�������������Դ���Br2��������KBr�����ǽ������ʼ���û���Ӧ����Ӧ�����ӷ���ʽΪCl2+2Br����2 Cl��+Br2 ��Br2�������л��ܼ������ڱ��гʳȺ�ɫ������ˮ�������ܣ������ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ��Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ���²�Ϊ��ɫ��
��5����ΪK����4���ڣ�����A�壬��Kͬ���壬�������ڵ�Ԫ�ص���ΪNa�����ĵ�����������Na��������ȼ�յ�������ΪNa2O2��Na2O2�ĵ���ʽΪ![]() ���ܢ��Ԫ�ص����ӷֱ�ΪF����Cl����Br�������ǵ�Ԫ������ͬ���壬��ͬ����Ԫ����˵�����ϵ��£��ǽ����Լ��������ʵ������Լ�������Ӧ���ӵĻ�ԭ��������ǿ����ԭ����ǿ����˳��ΪBr����Cl����F����
���ܢ��Ԫ�ص����ӷֱ�ΪF����Cl����Br�������ǵ�Ԫ������ͬ���壬��ͬ����Ԫ����˵�����ϵ��£��ǽ����Լ��������ʵ������Լ�������Ӧ���ӵĻ�ԭ��������ǿ����ԭ����ǿ����˳��ΪBr����Cl����F����

 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�