��Ŀ����
����Ŀ������ѧ��ѡ��2����ѧ�뼼������ú����ȼú�糧�ų�����Ҫ�������ҹ���糧��ú�ҵ���Ҫ���������Ϊ��SiO2��Al2O3��CaO�ȡ�һ�����÷�ú����ȡ�������Ĺ����������£�

��1����ú����ĥ��Ŀ���� ��
��2����1�ι�����������Ҫ�ɷ��� �� ���ѧʽ, ��ͬ��,��3�ι���ʱ�������ijɷֵ��� ��
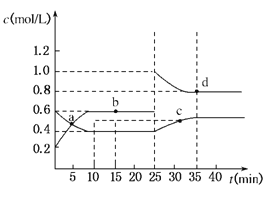
��3����104���������ȡʱ�����Ľ�ȡ����ʱ��Ĺ�ϵ����ͼ1�����˵Ľ�ȡʱ��Ϊ h�����Ľ�ȡ���롰���ܼ�/��ú�ҡ��Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�NH4F��KF����NH4F��KF�Ļ��������ܼ�/��ú����ͬʱ����ȡ����ߵ��� ���ѧʽ�����ú����Ļ��������������ܼ�ȱ���� ����һ������

��4��������ѭ��ʹ�õ������� �� ���ѧʽ����
��5���������ܽ����������壬�ܹ�������ԭ���� ��
��6���÷�ú����ȡ�������������Ҫ������ ��
���𰸡���1����С���ȣ�����Ӵ��棬��߽�ȡ���ʺͽ�ȡ�ʣ�2�֣�
��2��SiO2��1�֣���CaSO4 ��1�֣���Al(OH)3��1�֣�
��3��2��1�֣���NH4F��1�֣������ɹ����в���HF��NH3����Ⱦ������2�֣�
��4��H2SO4��1�֣���NH4Cl��1�֣�
��5��ͨ��HClʹAlCl3��6H2O���ͣ���Al2(SO4)3�����ͣ�2�֣�
��6��ʹ����������Դ�����ã�2�֣�
��������
�����������ú�ҵ���Ҫ���������ΪSiO2��Al2O3��CaO�ȣ�����������ҺʹAl2O3�ܽ⣬CaOͨ����Ӧ����CaSO4��CaSO4�ܣ���CaSO4��SiO2һ���Ϊ���������˺���Һ��ȴ�ᾧ��Al2��SO4��3���������ܽ�Al2��SO4��3����ͨ���Ȼ����AlCl36H2O�����������Һ�����˵�������Һ������ѭ�����ã�AlCl36H2O�����ܽ����Ȼ�����Һ��ͨ�백�������������������Ȼ����Һ���Ȼ����Һ����ѭ�����ã����������������ȷֽ�����Al2O3��
��1����ú����ĥ��Ŀ������С���ȣ�����Ӧ��ĽӴ��������߽�ȡ���ʺͽ����ʣ�
��2��ͨ�����Ϸ�����֪����1�ι���ʱ��������Ҫ�ɷ���SiO2�� CaSO4����3�ι���ʱ�����ijɷ���Al��OH��3��
��3������ͼ1��֪��2hʱ���Ľ����ʴﵽ���ֵ���������˵Ľ�ȡʱ��Ϊ2h������ͼ2��֪����n(���ܼ�)/n(��ú��)��ͬʱ��NH4F���ܼ������Ľ�������ߣ��ú����Ļ��������������ܼ���ȱ�������������л������Ⱦ������HF��NH3�ȣ�
��4����������ķ�����֪��������ѭ��ʹ�õ�������H2SO4��NH4Cl��
��5���������ܽ����������壬��ͨ��HCl���壬����AlCl36H2O���ù����ܹ�������ԭ����ͨ���Ȼ���ʹAlCl36H2O�ﵽ���ͣ��������������ͣ�����AlCl36H2O��������
��6���÷�ú����ȡ�������������Ҫ��������ʹ����������Դ�����á�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��[��ѧ��ѡ��3�����ʽṹ������] ��ѧ��Ϊһ�Ż�����Ȼ��ѧ���ڲ��Ͽ�ѧ��������ѧ����Դ��ѧ�������������Ҫ���á�
��1�����³��������Ʊ�ͭ���Ļ�ѧʽΪYBaCu3O7������1/3��Cu�Ժ�����Cu3+��ʽ���ڡ�Cu��Ԫ�����ڱ��е�λ��Ϊ____ ����̬Cu3+�ĺ�������Ų�ʽΪ_ _______��
��2�����Բ���������Ϳ�ѧ������Ӧ�ù㷺���о������������ɻ��������������δ�ɶԵ���ʱ����û�������д��ԡ����������ʺ���¼���Ŵ��ŷ�ԭ�ϵ�Ϊ____����ѡ����ĸ����
A��V2O5 | B��CrO2 | C��PbO | D��ZnO |
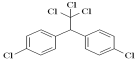
��3�����������ڿ�űҩ�����������о��еĽܳ����ף���Ϊ���ѧ��ŵ���������й��ˡ������صĽṹ��ʽ��ͼl��ʾ�������Ԫ�صĵ縺���ɴ�С��˳��Ϊ ��̼ԭ�ӵ��ӻ���ʽ��____ ��
��4������ȼ������������ȾС����Ϊδ��ʯ�͵������Դ���ɼ����ˮ�γɵ�����ȼ�����ṹ��ͼ2��ʾ��
�١���ȼ�����з��Ӽ���ڵ�2��������Ϊ ��
��H2O��VSEPRģ��Ϊ ���Ƚϼ��ǵĴ�С��H2O CH4������>����<������=������ԭ��Ϊ ��
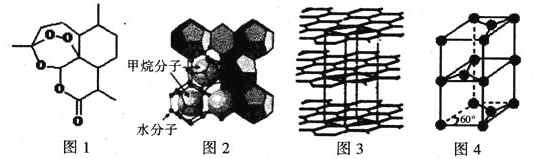
��5������ӵ���ڱ�Яʽ�����豸�Լ��綯���������ǵ�������ʾ��������Ӧ��ǰ�����õ�ظ�������Ϊʯī��ʯīΪ��״�ṹ����ͼ3�����侧���ṹ��ͼ4��ʾ���þ������� ��̼ԭ�ӡ���֪ʯī�IJ���Ϊapm��C-C����Ϊb pm������٤��������ֵΪNA����ʯī������ܶ�Ϊ g��cm-3(�г�����ʽ)��