题目内容
5.下列各组中的性质比较,不正确的是( )| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 非金属性:F>O>S | D. | 稳定性:PH3<H2S<HCl |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.水、HF含有氢键,沸点较高,且水中含有的氢键较多,不存在氢键的分子,相对分子质量越大,分子间作用力越强;
C.同周期元素从左到右,元素的非金属性逐渐增强,同主族元素从上到下,元素的非金属性逐渐减弱;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B.水、HF含有氢键,沸点较高,且水中含有的氢键较多,不存在氢键的分子,相对分子质量越大,分子间作用力越强,应为H2O>HF>HBr>HCl,故B错误;
C.同周期元素从左到右,元素的非金属性逐渐增强,同主族元素从上到下,元素的非金属性逐渐减弱,故C正确;
D.非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选B.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列物质一定与丁烯互为同系物的是( )
| A. | C2H4 | B. | C3H6 | C. | C4H8 | D. | C4H10 |
16.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,1L辛烷完全燃烧所生成的气态产物的分子数为8NA22.48NA22.4 | |
| B. | 1 mol羟基(-OH)所含的电子总数为7NA | |
| C. | 0.5mol 丙烯醛(CH2=CH-CHO)与足量银氨溶液反应,转移的电子数为2NA | |
| D. | 1 mol碳正离子(CH+3)所含的电子总数为8NA |
13.欲配制100ml 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100ml水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100ml
③将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml.
①将14.2g Na2SO4溶于100ml水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100ml
③将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml.
| A. | ①② | B. | ①②③ | C. | ①③ | D. | ②③ |
20.NaHSO4在水溶液中能够电离出H+、Na+、和SO42-.下列对于NaHSO4的分类中不正确的是( )
| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
4.一定温度下,可逆反应:A(g)+3B(g)?2C(g)在一密闭恒容容器内达到平衡的标志是( )
| A. | 容器内气体C的物质的量不再改变 | |
| B. | 容器内混合气体的A、B、C的浓度之比为1:3:2 | |
| C. | 单位时间内生成 n mol的A,同时消耗2n mol的C | |
| D. | 正、逆反应均不再进行 |
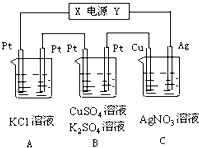 如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:
如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答: ②
② ③
③ ④
④