题目内容
13.欲配制100ml 1.0mol/L Na2SO4溶液,正确的方法是( )①将14.2g Na2SO4溶于100ml水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100ml
③将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml.
| A. | ①② | B. | ①②③ | C. | ①③ | D. | ②③ |
分析 ①14.2gNa2SO4的物质的量为$\frac{14.2g}{142g/mol}$=0.1mol,根据c=$\frac{n}{V}$以及溶液的体积不等于溶剂的体积来分析;
②根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,据此计算稀释后浓度,进行判断;
③32.2gNa2SO4•10H2O物质的量为$\frac{32.2g}{322g/mol}$=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,根据c=$\frac{n}{V}$计算判断.
解答 解:①14.2gNa2SO4的物质的量为$\frac{14.2g}{142g/mol}$=0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故②正确;
③32.2gNa2SO4•10H2O物质的量为$\frac{32.2g}{322g/mol}$=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=$\frac{0.1mol}{0.1L}$=1.0mol•L-1,故③正确;
故选:D.
点评 本题主要考查配制一定物质的量浓度的溶液的配制及对物质的量浓度的理解、计算,难度不大,注意配制中物质溶于水溶质发生变化的情况以及稀释前后溶质的物质的量不变.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.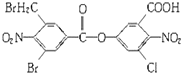 已知某有机物结构简式如图:1mol该有机物与足量NaOH溶液共热,充分反应最多可消耗a mol NaOH,则a值是( )
已知某有机物结构简式如图:1mol该有机物与足量NaOH溶液共热,充分反应最多可消耗a mol NaOH,则a值是( )
 已知某有机物结构简式如图:1mol该有机物与足量NaOH溶液共热,充分反应最多可消耗a mol NaOH,则a值是( )
已知某有机物结构简式如图:1mol该有机物与足量NaOH溶液共热,充分反应最多可消耗a mol NaOH,则a值是( )| A. | 6 mol | B. | 7 mol | C. | 8 mol | D. | 9 mol |
1.下列变化属于物理变化的是( )
| A. | 乙烯通入酸性高锰酸钾溶液褪色 | B. | 浓硝酸滴到皮肤变黄 | ||
| C. | 钙与酒精混合有气泡 | D. | 苯滴入溴水中振荡后水层接近无色 |
8.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46gNO2和 N2O4混合气体中含有原子总数为3NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | 7.1k氯气与足量NaOH溶液反应转移的电子数为0.2NA. | |
| D. | 1molC10H22分子中共价键总数为62 NA |
18.鉴别溶液和胶体的最简便方法是( )
| A. | 电解 | B. | 电泳 | C. | 丁达尔现象 | D. | 用显微镜观察 |
5.下列各组中的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 非金属性:F>O>S | D. | 稳定性:PH3<H2S<HCl |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下,22.0g C18O2气体中含有的碳原子数目为0.5NA | |
| B. | 1mol OH-中电子数为10NA | |
| C. | 标准状况下,22.4L乙醇中含有的氧原子数为1.0NA | |
| D. | 1mol C2Cl6分子含有7 NA个共价键 |
 则:
则: