��Ŀ����
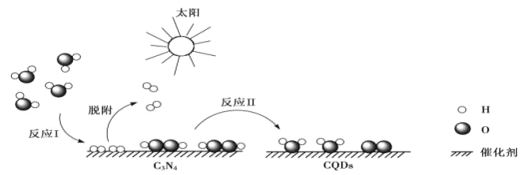
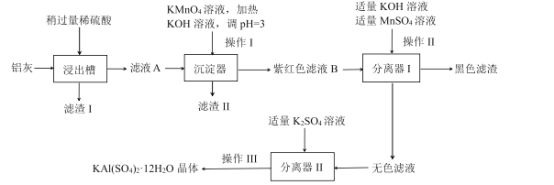
����Ŀ���������մɳ����ں�Ĥ���ɵ�·���Ʊ��������մɵĺϳ�·����ͼ��ʾ���ش��������⡣
��1�������������跢�������ӷ���ʽΪ��___��ʹ��˫��ˮ���������ŵ�Ϊ___��
��2�����ȷֽ⡱�õ��IJ�������������⣬����NH3��N2��SO2��SO3��H2O���ɣ�����������ͻ�ԭ��������ʵ���֮��Ϊ___��
��3�����������Ļ�ѧʽΪNH4Al(SO4)2��12H2O�����ȷֽ⡱�����У�����¶ȶ������ȡ�ʧ�ؼ���ֵ����ʧ�ؼ���ֵ%=![]() ��100%�������ʾ��
��100%�������ʾ��
�¶����䣨�棩 | 18��190 | 190��430 | 430��505 | 505��900 |
ʧ�ؼ���ֵ��%�� | 39.20 | 7.80 | 13.00 | 26.00 |
ͨ���������ݾ����Լ�����жϣ����¶�����___�����������ʧȥ��ȫ���ᾧˮ��
��4�����ᾧ�������г����õIJ�����___��
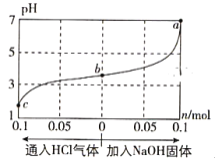
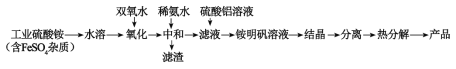
��5���ϳɹ����г�ʹ�ù����Ĺ�ҵ����泥��������������Һˮ������������������ˮ�⣬�����һ����Ҫ������___��
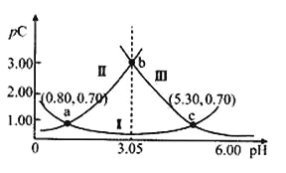
��6��ͨ����Ϊ��������Ũ�ȵ���1��10-5mol/L������Ϊ������ȫ���Լ��㳣���¡��к͡���������Ҫ������ҺpH=___������һλС������֪��Ksp[Fe(OH)3]=8.0��10��38��lg5=0.7����
���𰸡�2Fe2++H2O2+2H+=2Fe3++2H2O ��ԭ����Ϊˮ�����������ʡ�����Ⱦ���� 1��3 190��430 ����Ũ������ȴ�ᾧ ��ʹ���������ת��Ϊ������������������������ 3.3
��������
��1��������������������H2O2�������Խ�Fe2+����ΪFe3+��ͬʱH2O2����ԭΪH2O�����������ʡ�����Ⱦ������
��2����������ΪN2����ԭ����ΪSO2�����õ�ʧ�����غ���м��㣻
��3������������Ϣ������������������ʧȥ��ȫ���ᾧˮʱ��ʧ�ؼ���ֵ��
��4������Һ���������壬һ��������Ũ������ȴ�ᾧ��
��5���ϳɹ����г�ʹ�ù����Ĺ�ҵ����泥��������������Һˮ������������������ˮ�⣬�����һ����Ҫ���ÿ��ԴӴ�ԭ�������ʵĽǶȻش�
��6������������Ϣ���������ȫ������ʱ����Ҫ���ڵ�pH��
��1��������������������H2O2�������Խ�Fe2+����ΪFe3+��ͬʱH2O2����ԭΪH2O�������ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��ʹ��˫��ˮ���������ŵ��ǻ�ԭ����Ϊˮ���������ʡ�����Ⱦ������
��2����������ΪN2����ԭ����ΪSO2�����õ�ʧ�����غ���ʽ���£�n(N2)��2��3e����n(SO2)��2e�������n(N2):n(SO2)��1:3��
��3��NH4Al(SO4)2��12H2O�ᾧˮ�ĺ�������Ϊ47.7%��ǰ�����¶ȶ��ڣ���ʧ�ؼ���ֵ��֮��Ϊ39.20%+7.80%��47%������190��430�¶ȶ��ڣ������������ʧȥ��ȫ���ᾧˮ��
��4���õ����ᾧˮ�ľ��峣���õķ���������Ũ������ȴ�ᾧ��
��5��ʹ����粒�������������������ַ�Ӧ��������������������ʣ�
��6�����������������ܶȻ�������֪1��10��5��c3(OH��)��8.0��10��38�����c(OH��)��2��10��11��mol/L����![]() ��pH��4-lg5��3.3��
��pH��4-lg5��3.3��

����Ŀ����ͼ��Ԫ�����ڱ���һ���֣������г��ˢ�~��Ԫ�ء�
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� |
��Ԫ�ط��Ż�ѧʽ��д���пո�
(1)��~��Ԫ���У�ԭ�Ӱ뾶����Ԫ����_______(��Ԫ�ط���)������������Ӧˮ������������ǿ��������____________________(����Ļ�ѧʽ)��
(2)�ٵ���̬�⻯��ĵ���ʽΪ_________________��
(3)��~��Ԫ���У��۵���������ļ���______�ܵ���������(�����ڡ�С�ڻ������)���ڵ��⻯���ȶ���______�ߵ��⻯��(�����ڡ�С�ڻ������)��