题目内容
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
【答案】B
【解析】
化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,8.8g二氧化碳的物质的量为![]() =0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,7.2g水的物质的量为
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,7.2g水的物质的量为![]() =0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,故化合物中N(C)∶N(H)=0.2mol∶0.8mol=1∶4,由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,综上分析可知,①③错误,②④正确,故选B。
=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,故化合物中N(C)∶N(H)=0.2mol∶0.8mol=1∶4,由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,综上分析可知,①③错误,②④正确,故选B。

 阅读快车系列答案
阅读快车系列答案【题目】如图是全钒液流储能电池的示意图,a、b是碳电极,几种含钒元素的离子在水溶液中颜色如表所列,全钒液中还含有H+、SO42-,下列说法中错误的是

V2+ | V3+ | VO2+ | VO2+ |
紫色 | 绿色 | 蓝色 | 黄色 |
A.当外接负载时,右槽溶液若逐渐由紫变绿,则b为负极
B.当外接负载时,电流若由a流出,则左槽溶液的pH增大
C.当b与外接电源负极相连时,则b极发生V3++e—=V2+
D.充电时若电路中转移0.1 mol电子,则左槽溶液中n(H+)的变化量为0.2 mol
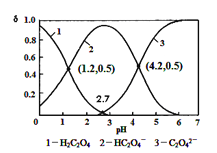
【题目】“中和滴定原理在实际生产生活中应用广泛某化学学习小组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资和网络查寻,得知草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
回答下列问题:
(1)该滴定实验所需的玻璃仪器有______。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(50mL) D.锥形瓶 E.烧杯
(2)滴定终点的现象为_____________________________________________________。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.100mol·L-1KMnO4的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 滴液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度______________。(计算结果保留四位有效数字)
(4)讨论:若滴定到终点时俯视滴定管刻度线读数,则由此测得的x值会______________(填“偏大”、“偏小”或“不变”)。