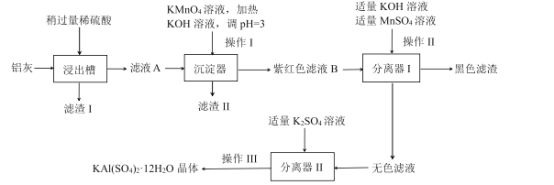
题目内容
【题目】白铜是一种铜镍合金,为我国首先发明使用并传入世界各地,其发明在世界化学史和冶金史中都占有重要地位。白铜广泛用于造船、石油、化工、建筑、电力、精密仪表、医疗器械、乐器制作等部门作耐蚀的结构件。
(1)镍元素基态原子的电子排布式为______________,3d能级上的未成对电子数为______。
(2)单质铜、镍都是通过__________ 键形成晶体;比较元素铜与镍的第二电离能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金属镍粉在CO气流中轻微加热,生成无色(或黄色)易挥发的液体Ni(CO)4。 写出一种与Ni(CO)4的配体互为等电子体的物质的分子式_____ ;推测Ni(CO)4的晶体类型是_______。呈正四面体构型的Ni( CO)4。易溶于下列物质中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
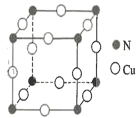
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为______该化合物的摩尔质量为M g●mol-1, NA代表阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是_____g .cm-3。
【答案】1s22s22p63s23p63d84s2或[Ar]3d84s2 2 金属 > Cu+失去的是全充满的3d10电子,Ni+再失去的是4s1电子 N2 分子晶体 BC Cu3N ![]() 或
或![]()
【解析】
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,其3d轨道有8个电子,根据核外电子排布规律可知未成对电子有2个;
(2)单质铜及镍都是金属晶体,都是由金属键形成的晶体;基态铜原子的核外电子排布为[Ar]3d104s1,铜失去最外层一个电子之后,再失去第二个电子失去的是全充满的3d10电子,镍失去的是4s1电子,所以铜的第二电离能大于镍的第二电离能;
(3)Ni(CO)4的配体为CO,等电子体中原子数和价电子数都相同,CN-、N2、CO的原子数都是2,价电子数都是10,则互为等电子体,所以与CO互为等电子体的分子为N2;根据题目信息可知Ni(CO)4是液态挥发性物质,所以其熔点较低,故为分子晶体;Ni(CO)4呈正四面体构型,是对称结构,所以是非极性物质,根据相似相溶原理知,Ni(CO)4 易溶于非极性溶剂,苯、四氯化碳是非极性物质,所以Ni(CO)4 易溶于苯、四氯化碳,所以选BC;
(4)根据均摊法,N原子个数=8×![]() =1、Cu原子个数=12×
=1、Cu原子个数=12×![]() =3,所以其化学式为Cu3N;
=3,所以其化学式为Cu3N;
该晶胞的体积V=(a×10-10)3cm3,该化合物的摩尔质量为M g·mol-1,该物质的式量为M,则晶胞的质量为![]() g,所以晶胞的密度
g,所以晶胞的密度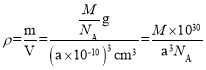 g·cm-3;Cu3N的式量为64×3+14,所以也可以写成
g·cm-3;Cu3N的式量为64×3+14,所以也可以写成![]() g·cm-3。
g·cm-3。

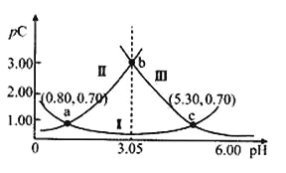
【题目】下列离子方程式不能用来解释相应实验现象的是
选项 | 实验现象 | 离子方程式 |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | Mg(OH)2+2NH4+ |
B | 向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色 | 2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH- |
C | 将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色) | 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ |
D | 氢氧化铁溶于HI溶液中 | 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
A.AB.BC.CD.D