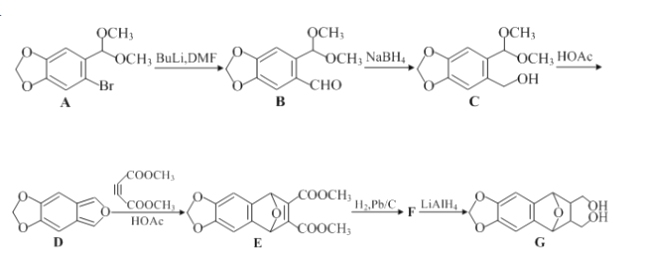
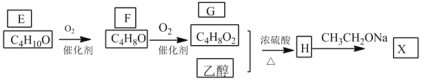
题目内容
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
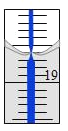
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
【答案】抑制Al3+水解 b、d 静置,取上层清液,继续加氨水,若无沉淀生成,则氨水已过量 2 ad 18.60 5
【解析】
(1)氯化铝水解显酸性;
(2)a、AlCl3和Na2CO3发生双水解;
b、AlCl3和过量的氢氧化钠反应生成NaAlO2溶液;
c、AlCl3和NaAlO2发生双水解;
d、AlCl3和硫酸不反应;
(3)判断试剂已过量的方法是继续滴加;当氨水加入过量时,去上层清液继续滴加氨水,则无沉淀生成;将所得的Al(OH)3沉淀至少灼烧2-3次,至两次质量差不超过0.1g即说明Al(OH)3分解完全得Al2O3,不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因是Al(OH)3热稳定性不如Al2O3好;
(4)滴定管的0刻度在上;根据0.1120mol HNO3的消耗有两个原因:被3.490gAl2(OH)nCl(6-n)中OH-消耗的和被0.1290mol/L的标准NaOH溶液消耗的,据此计算。
(1)氯化铝水解显酸性,加入盐酸能抑制其水解,故答案为:抑制Al3+水解;
(2)a、AlCl3和Na2CO3发生双水 2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑,得不到澄清溶液,故a错误;
b、AlCl3和过量的氢氧化钠反应生成NaAlO2溶液:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,得澄清溶液,故b正确;
c、AlCl3和NaAlO2发生双水 AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,得不到澄清溶液,故c错误;
d、AlCl3和硫酸不反应,故溶液仍为澄清,故d正确;
bd正确,故答案为:bd;
(3)判断试剂已过量的方法是继续滴加,即当氨水加入过量时,去上层清液继续滴加氨水,则无沉淀生成;将所得的Al(OH)3沉淀至少灼烧2-3次,至两次质量差不超过0.1g即说明Al(OH)3分解完全得Al2O3,不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因是干燥Al(OH)3时易分解失水而灼烧Al2O3不失水;故答案为:静置,取上层清液,滴加氨水,无沉淀生成;2;ad;
(5)滴定管的0刻度在上,故滴定管的读数为18.60mL,则消耗的氢氧化钠的体积为18.60mL;根据0.1120molHNO3的消耗有两个原因,被3.490gAl2(OH)nCl(6-n)中OH-消耗的和被0.1290mol/L的标准NaOH溶液消耗的,由此可得关系式:0.112mol=![]() ×n+0.129mol/L×0.0186L×5,解得n=5,故答案为:18.60;5。
×n+0.129mol/L×0.0186L×5,解得n=5,故答案为:18.60;5。