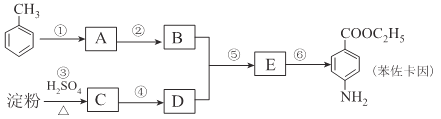
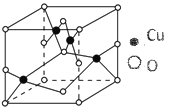
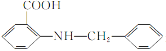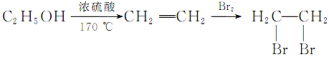题目内容
【题目】(1)下列反应中,属于放热反应的是 ,属于吸热反应的是 。①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(3)14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
【答案】(1)②③④⑤⑥;①;(2)1.12L;0.1mol;(3)吸热反应;CO2、CO、C。
【解析】
试题分析:(1)①煅烧石灰石属于吸热反应,错误;②所有的燃烧均是放热反应,故木炭燃烧属于放热反应,正确;③炸药爆炸属于放热反应,正确;④酸碱中和属于放热反应,正确;⑤生石灰与水作用制熟石灰属于放热反应,正确;⑥食物因氧化而腐败属于缓慢氧化,是放热反应,故上述反应属于放热反应的是②③④⑤⑥;属于吸热反应的是①;(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,Zn是负极,发生反应:Zn-2e-=Zn2+,工作一段时间,锌片的质量减少了3.25g;n(Zn)= 3.25g÷ 65g/mol=0.05mol,则电子转移的物质的量是n(e-)=2n(Zn)=0.01mol,在正极Cu上发生反应:2H++2e-=H2↑,则反应产生氢气的物质的量是n(H2)= n(Zn)=0.05mol,在标准状况下的体积是V(H2)=n(H2)·Vm = 0.05mol×22.4L/mol=1.12L;导线中通过0.01mol电子。(3)14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,该反应是吸热反应,达到平衡后,由于反应混合物是各种反应物、生成物都存在的状态,所以平衡混合物中含14C的粒子有CO2、CO、C。
2CO,该反应是吸热反应,达到平衡后,由于反应混合物是各种反应物、生成物都存在的状态,所以平衡混合物中含14C的粒子有CO2、CO、C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案