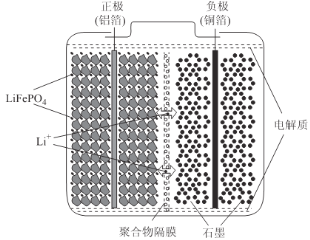
题目内容
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
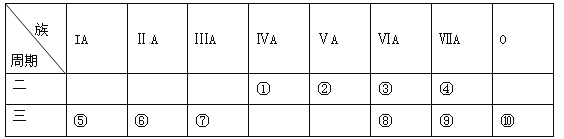
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
【答案】(1)F,C;
(2)Cl,NaOH,Al(OH)3;
(3)Na>Mg>Al
【解析】试题分析:根据这几种元素在周期表中的位置可知①号元素是C元素,②号是N元素,③号是O元素,④号是F元素,⑤号是Na元素,⑥号是Mg元素,⑦号是Al元素,⑧号是S元素,⑨号是Cl元素,⑩号是Ar元素,(1)非金属性最强的是F元素,形成化合物种类最多的是C元素,答案为:F、C;(2)主族元素电子层数相同时,核电荷越多原子半径越小,所以第三周期元素除⑩外原子半径最小的是Cl元素,金属性越强,最高价氧化物对应水化物的碱性越强,金属性越强的是Na元素,所以碱性最强的是NaOH,具有两性的是Al(OH)3,答案为:Cl , NaOH , Al(OH)3;(3)Na、Mg、Al的活动性由强到弱的顺序为:Na>Mg>Al,答案为:Na>Mg>Al.

【题目】在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |