题目内容
【题目】【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
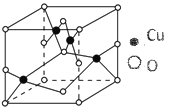
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
【答案】
(1)[Ar]3d10,
(2)CuO;
(3)①sp3;②H3O+;
(4)NH3分子间能够形成氢键;
(5)高;CuO的阴阳离子半径小于CuCl的离子半径,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大。
【解析】
试题分析:(1)Cu的原子序数为29,价电子排布为3d104s1,则基态Cu+的核外电子排布式为[Ar]3d10,故答案为:[Ar]3d10;
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×![]() +6×
+6×![]() =4个,原子个数之比为1:1,该氧化物的化学式为CuO,故答案为:CuO;
=4个,原子个数之比为1:1,该氧化物的化学式为CuO,故答案为:CuO;
(3)①[Cu(NH3)4]SO4H2O中S原子的价层电子对数目=4+![]() ×(6+2-4×2)=4,采用sp3杂化,故答案为:sp3;
×(6+2-4×2)=4,采用sp3杂化,故答案为:sp3;
②与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,阳离子为H3O+,故答案为:H3O+;
(4) NH3分子间能够形成氢键,而PH3不能,导致NH3的沸点高于PH3,故答案为:NH3分子间能够形成氢键;
(5)CuO和CuCl都是离子晶体,离子晶体中晶格能越大,熔点越高,晶格能与离子的半径和电荷有关,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,CuO的阴阳离子半径小于CuCl的离子半径,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,所以CuO的熔点比CuCl的熔点高,故答案为:CuO的阴阳离子半径小于CuCl的离子半径,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大。