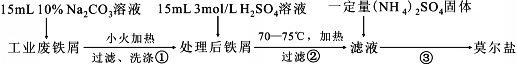
题目内容
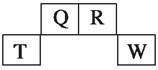
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T元素的离子结构示意图为__________。
(2)元素的非金属性(原子得电子的能力):Q ________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为_________________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_________________________________________________________其反应物的电子式为 。离子半径T3+__________R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【答案】(1)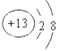 ;
;
(2)弱于;
(3)S+2H2SO4(浓)![]() 3SO2↑+2H2O;
3SO2↑+2H2O;
(4)2H2O2![]() 2H2O+O2↑ ;
2H2O+O2↑ ;![]() ; <;
; <;
(5)NaNO2.
【解析】试题分析:根据元素在周期表中的位置可知,T是第三周期,所以T是Al,则Q是C,R 是N,W是S。(1)铝离子只与2个电子层,离子结构示意图为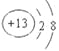 ;(2)硫酸的酸性强于碳酸的,所以碳的非金属性弱于硫的非金属性;(3)浓硫酸具有氧化性,在加热的条件下能和单质硫反应生成SO2和水,方程式为S+2H2SO4(浓)
;(2)硫酸的酸性强于碳酸的,所以碳的非金属性弱于硫的非金属性;(3)浓硫酸具有氧化性,在加热的条件下能和单质硫反应生成SO2和水,方程式为S+2H2SO4(浓)![]() 3SO2↑+2H2O;(4)原子序数比R多1的元素是氧元素,对应的氢化物是双氧水和水。双氧水不稳定,分解生成氧气和水,方程式为2H2O2
3SO2↑+2H2O;(4)原子序数比R多1的元素是氧元素,对应的氢化物是双氧水和水。双氧水不稳定,分解生成氧气和水,方程式为2H2O2![]() 2H2O+O2↑ 。双氧水是含有极性键和非极性键的共价化合物,电子式为
2H2O+O2↑ 。双氧水是含有极性键和非极性键的共价化合物,电子式为![]() 。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径T3+<R3-;(5)氮元素的氧化物中相对分子质量最小的是NO,在反应中体积之比是气体的物质的量之比,所以根据电子得失守恒可知,NO中氮原子失去
。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径T3+<R3-;(5)氮元素的氧化物中相对分子质量最小的是NO,在反应中体积之比是气体的物质的量之比,所以根据电子得失守恒可知,NO中氮原子失去![]() ,所以其氧化产物的价态是+(2+1)=+3价,即含氧酸盐是亚硝酸钠。
,所以其氧化产物的价态是+(2+1)=+3价,即含氧酸盐是亚硝酸钠。

 考前必练系列答案
考前必练系列答案