题目内容
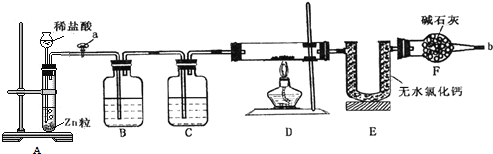
【题目】用含铁废铜制备胆矾的流程如下图所示:
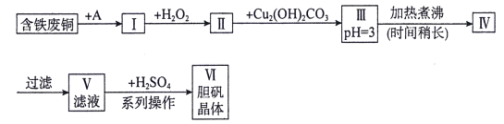
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
【答案】A
【解析】
含铁废铜制备胆矾,首先将金属溶解,A为稀硫酸,溶解除铜以外的其他金属;再加入强氧化性的过氧化氢,将铜溶解,同时将存在的亚铁离子氧化为铁离子,加入Cu2(OH)2CO3,调节溶液的pH,将铁变成氢氧化铁沉淀除去;最后进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有![]() ,加硫酸其目的是抑制Cu2+的水解,进行蒸发浓缩,冷却结晶,过滤,洗涤得到产品胆矾。
,加硫酸其目的是抑制Cu2+的水解,进行蒸发浓缩,冷却结晶,过滤,洗涤得到产品胆矾。
A. 物质A选用稀硫酸溶解除铜外的其他金属,不能是盐酸,会引入氯离子的杂质,A错误;
B. H2O2具有强氧化性,能将Fe2+氧化为Fe3+,也能在酸性环境下溶解铜,B正确;
C. 长时间加热煮沸的目的是充分聚沉Fe(OH)3,以便过滤除去,C正确;
D. 得到胆矾晶体的操作是蒸发浓缩,冷却结晶,过滤,洗涤,D正确;
故答案为:A。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目