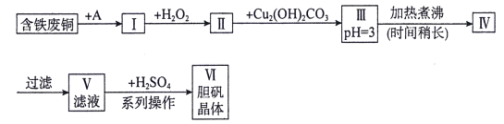
题目内容
【题目】对高温条件下反应机理的研究一直是化学动力学的重要课题,科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:
![]() ①
①![]()
![]() ②
②![]()
![]() ③
③![]()
![]() ④
④![]()
![]() ⑤
⑤![]()
回答下列问题:
(1)上述历程是根据两个平行反应提出的,其中一个为CH3COCH3![]() CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,写出该反应的化学方程式:____________________________________。
(3)一定温度下,在2L密闭容器中充入1molCH3COCH3发生上述两个平行反应,提高乙烯酮反应选择性的关键因素是___________;
a.再充入1molCH3COCH3 b.及时分离出CH4 c.使用适宜的催化剂
达到平衡后,测得容器中存在a molCH4和b mol CO,则CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
(4)分解产物中的CH4可用于制备氢气:
反应I:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1
CO(g)+3H2(g) △H=206.2kJ·mol-1
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1
CO2(g)+4H2(g) △H=165.0kJ·mo1-1
写出CO与水蒸气反应生成CO2的热化学方程式:_________________。830℃时,反应Ⅱ的平衡常数K=1.2mol2·L-2,该温度下,测得密闭容器中各物质的浓度为c(CH4)=2.0mol·L-1、c(H2O)=4.0mol·L-1、c(CO2)=2.0mol·L-1、c(H)=2.0mol·L-1,则此时v正_____v逆(填“>”“<”或“=”)。
【答案】① 2CH3COCH3![]() CH4+CO+C2H5COCH3 < CH2=C=O+CH3CH2OH→CH3COOCH2CH3 c a(a-b)/(2-2a-2b) CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1 >
CH4+CO+C2H5COCH3 < CH2=C=O+CH3CH2OH→CH3COOCH2CH3 c a(a-b)/(2-2a-2b) CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1 >
【解析】
(1)根据反应历程分析,两个平行反应为:①CH3COCH3![]() CH4+CH2=C=O、②2CH3COCH3
CH4+CH2=C=O、②2CH3COCH3![]() CH4+CO+C2H5COCH3,①反应的快慢主要由上述历程中活化能大的反应①决定,根据反应④和反应⑤,反应④生成甲基自由基,甲基自由基浓度增大,比较反应④和⑤的活化能,反应⑤速率更快,则反应速率常数k4<k5,故答案为:①;2CH3COCH
CH4+CO+C2H5COCH3,①反应的快慢主要由上述历程中活化能大的反应①决定,根据反应④和反应⑤,反应④生成甲基自由基,甲基自由基浓度增大,比较反应④和⑤的活化能,反应⑤速率更快,则反应速率常数k4<k5,故答案为:①;2CH3COCH![]() CH4+CO+C2H5COCH3;<;
CH4+CO+C2H5COCH3;<;
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,该反应的化学方程式:CH2=C=O+CH3CH2OH→CH3COOCH2CH3,故答案为:CH2=C=O+CH3CH2OH→CH3COOCH2CH3;
(3)提高乙烯酮反应选择性的关键因素是催化剂的选择;达到平衡时,根据2CH3COCH3![]() CH4+CO+C2H5COCH3反应中,生成的CO为bmol,则该反应中生成的CH4也是bmol,所以CH3COCH3(g)
CH4+CO+C2H5COCH3反应中,生成的CO为bmol,则该反应中生成的CH4也是bmol,所以CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)反应中,生成的CH4是(a-b)mol,CH2=C=O等于(a-b)mol,剩下的CH3COCH3的物质的量为(1-a-b)mol,则反应CH3COCH3(g)
CH4(g)+CH2=C=O(g)反应中,生成的CH4是(a-b)mol,CH2=C=O等于(a-b)mol,剩下的CH3COCH3的物质的量为(1-a-b)mol,则反应CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)的平衡常数为
CH4(g)+CH2=C=O(g)的平衡常数为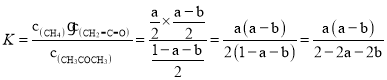 mol·L-1,故答案为:c;
mol·L-1,故答案为:c;![]() ;
;
(4)①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1;②CH4(g)+2H2O(g)
CO(g)+3H2(g) △H=206.2kJ·mol-1;②CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1;根据盖斯定律②-①可的:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;830℃时,
CO2(g)+4H2(g) △H=165.0kJ·mo1-1;根据盖斯定律②-①可的:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;830℃时,![]() ,所以正反应速率大于逆反应速率,故答案为:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;>。
,所以正反应速率大于逆反应速率,故答案为:CO(g)+H2O(g)=CO2+H2(g) △H=-41.2 kJ·mol-1;>。