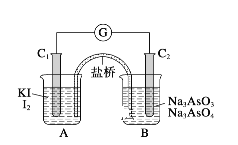
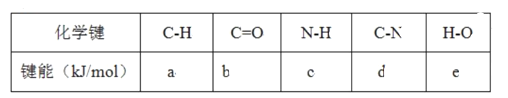
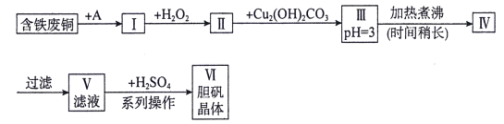
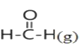题目内容
【题目】(1)天然气是一种清洁高效的能源,其主要成分为甲烷。
CH4的摩尔质量为_____________, 4.8 g CH4的物质的量为______________,在标准状况下的体积约为_______________,所含氢原子数为_______________。
(2)某化学兴趣小组对某矿泉水进行检测, 发现0.5 L该矿泉水中含有10.8 mg Mg2+,则Mg2+的物质的量浓度为______________。
【答案】16g/mol 0.3mol 6.72L 7.224×1023(或1.2×6.03×1023) 9×10-4mol/L
【解析】
(1)根据甲烷的相对分子量完成甲烷的摩尔质量;根据n=![]() 计算出甲烷的物质的量,然后再根据计算出甲烷的标况下的体积、含有氢原子的数目;
计算出甲烷的物质的量,然后再根据计算出甲烷的标况下的体积、含有氢原子的数目;
(2)根据n=![]() 计算出镁离子的物质的量,再根据c=
计算出镁离子的物质的量,再根据c=![]() 计算出镁离子的物质的量浓度。
计算出镁离子的物质的量浓度。
(1)甲烷的相对分子量为16,所以甲烷的摩尔质量为16g/mol;4.8g甲烷的物质的量为n=![]() =0.3mol;标准状况下0.3mol甲烷的体积为V=22.4L/mol×0.3mol=6.72L;0.3mol甲烷中含有1.2mol氢原子,含有氢原子的数目为6.03×1023×1.2=7.224×1023,故答案为:16g/mol;0.3mol;6.72L;7.224×1023(或1.2×6.03×1023);
=0.3mol;标准状况下0.3mol甲烷的体积为V=22.4L/mol×0.3mol=6.72L;0.3mol甲烷中含有1.2mol氢原子,含有氢原子的数目为6.03×1023×1.2=7.224×1023,故答案为:16g/mol;0.3mol;6.72L;7.224×1023(或1.2×6.03×1023);
(2)10.8mg Mg2+的物质的量为n=![]() =4.5×10-4mol,镁离子的物质的量浓度为c(Mg2+)=
=4.5×10-4mol,镁离子的物质的量浓度为c(Mg2+)=![]() mol=9×10-4mol/L,故答案为:9×10-4mol/L。
mol=9×10-4mol/L,故答案为:9×10-4mol/L。

练习册系列答案
相关题目