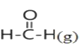题目内容
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
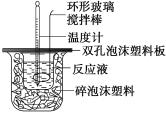
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
【答案】减少热量损失 不能 铁会和盐酸反应;铁导热性好,热量损失较大 为了确保盐酸完全被中和 不相等 相等 NaOH(aq)+HCl(aq)= NaCl(aq)+ H2O (l) ΔH=-57.3 kJ/mol C abcd
【解析】
(1)中和热测定实验成败的关键是保温工作;
(2)铁是热的良导体,易传热,且铁能与盐酸反应;
(3)氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,结合中和热的概念和实质来回答;
(4)根据稀强酸与稀强碱中和生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(5)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(6)从对热量的影响分析即可。
(1)中和热测定实验成败的关键是保温工作,烧杯间填满碎泡沫塑料的作用是:减少实验过程中的热量损失;
(2)铁是热的良导体,易传热,热量散失较大,实验测得误差较大,且铁能与盐酸反应;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是以强酸和强碱反应生成1mol水时放出的热为标准,与酸碱的用量无关;
(4)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,盐酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O (l)△H=-57.3 kJ/mol;
(5)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故答案为C;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a符合题意;
b.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故b符合题意;
c.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故c符合题意;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d符合题意;
故答案为:abcd。

 名校课堂系列答案
名校课堂系列答案