题目内容
【题目】化学反应不仅有物质变化,同时还伴随着能量的变化,化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____。
(2)已知已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g液态水时放出的热量是__________ kJ(结果保留两位小数)
(3)已知热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol,2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
①现有H2和C3H8的混合气体共5mol,完全燃烧时放热3472.9kJ,则混合气体中H2和C3H8的体积比为__________。
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热_________ kJ。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol 25.96 3:1 4725.8
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol 25.96 3:1 4725.8
【解析】
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则1mol CH3OH与氧气充分反应,生成二氧化碳气体和水时释放出725.76kJ的热量,表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol;
(2)葡萄糖的燃烧热是2804kJ/mol,可知葡萄糖的燃烧热的热化学方程式为C6H12O6(s)+6O2![]() 6CO2(g)+6H2O(l)△H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g 液态水时放出的热量是xg,
6CO2(g)+6H2O(l)△H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g 液态水时放出的热量是xg,
可得:
![]() =
=![]() ;
;
解得:x=25.96kJ;
(3)①设混合气中H2的物质的量为x,则C3H8的物质的量为5mol-x.根据题意,列方程为:285.8kJ/mol×x+2220.0kJ/mol×(5mol-x)=3472.9kJ;
解得 x= 3.75mol;C3H8的物质的量为5mol-3.75mol=1.25mol;
所以混合气体中H2与C3H8的体积比即物质的量之比为3:1;
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热285.8kJ/mol×1mol +2220.0kJ/mol×2mol =4725.8kJ 。

【题目】下图是元素周期表的一部分:
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | ⑧ | ||||||||||||||
Fe | |||||||||||||||||
Ⅰ.用化学用语回答下列问题:
(1)①、②、⑥形成的化合物中存在的化学键类型有________。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。
(3)写出②的离子结构示意图为__________。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。Y的水溶液与洁厕灵混合使用会产生一种有毒气体,该反应的离子方程式为_______。
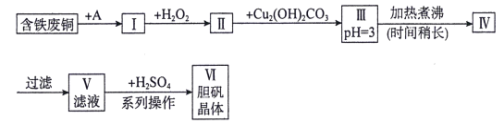
Ⅱ.A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
![]()
(1)若A是一种金属单质,C是淡黄色固体,写出C的一种用途_____;
(2)若A、B、C均为化合物且含有同一种金属元素,D是会造成温室效应的一种气体,请写出D的电子式_____,A和C反应的离子方程式 ___。
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________。