��Ŀ����
����Ŀ��I��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����
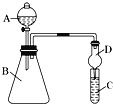
(1)����A������Ϊ______________�������D��������______________��
(2)��Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4��(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ��װ��C�е�ʵ������Ϊ������Һ������д��ʹ������Һ���������ӷ���ʽ__________________________________________��
(3)ʵ����������ҩƷ����ϡ���� ��ϡ���� ��Na2SiO3��Һ ��Na2CO3 ��CaCO3���壬��ѡ�����ҩƷ���ʵ����֤C��Si��S�ķǽ����Եı仯���ɣ�װ��A��B����װҩƷ�ֱ�Ϊ_______��____________��(�����)
������Zn��Cu2��===Zn2����Cu�ķ�Ӧ���ԭ��ء�
(1)ԭ�����ʹ�õĵ������Һ��__________________��
(2)д���缫��Ӧʽ��������___________________________������______________________________��
(3) ����������6.02��1023������ͨ��ʱ����ظ�����������____________g��
���𰸡���Һ©�� ������ Cl2 +2I- = I2 + 2Cl- �� �� CuSO4 /CuCl2/Cu(NO3)2 Zn - 2e- = Zn2+ Cu2+ +2e- =Cu 32.5g
��������
I����1�����������Ĺ���д������A�����ƣ����θ���ܾ��з�ֹ���������ã�
��2�����ʵ����֤�ǽ����ԣ�Cl>I������������KI������ԭ��Ӧ����֤��
��3��Ҫ֤���ǽ����ԣ�S>C>Si������ǿ��������ԭ��֤����
������ʧ�������Ը�����Zn������ѡ���п�����Ͳ�Ľ�����ʯī���������Һ���ݷ���ʽ��֪��ѡ�������ͭ�Ρ�
I����1������AΪ��Һ©�������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У�
�𰸣���Һ©�� ������
��2�����ʵ����֤�ǽ����ԣ�Cl>I������������KI������ԭ��Ӧ����֤����װ��A��B��C����װҩƷӦ�ֱ�ΪŨ���ᡢKMnO4�����۵⻯�أ�װ��C�е�ʵ������Ϊ��Һ������װ��C�з�����Ӧ�����ӷ���ʽΪCl2 +2I- = I2 + 2Cl-��
�𰸣�Cl2 +2I- = I2 + 2Cl-
��3���ǽ�����Խǿ�����������ˮ��������Խǿ��Ҫ֤���ǽ����ԣ�S>C>Si������ǿ��������ԭ��֤����A�п��Լ����ᣬB�м�Na2CO3��H2SO4+Na2CO3=Na2SO4+H2O+CO2����Ȼ���CO2ͨ��C�е�Na2SiO3�У����Է�����Ӧ��Na2SiO3+CO2+H2O=H2SiO3��+Na2CO3��������ɫ��״�������Ӷ�����֤�����ԣ�H2SO4>H2CO3>H2SiO3���ʷǽ����ԣ�S>C>Si��
�𰸣� �� ��
�������Ϸ�����֪
(1)ԭ�����ʹ�õĵ������Һѡ�������ͭ�Σ�
�𰸣�CuSO4 /CuCl2/Cu(NO3)2
(2)д���缫��Ӧʽ��������Zn - 2e- = Zn2+��������Cu2+ +2e- =Cu��
�𰸣�Zn - 2e- = Zn2+ Cu2+ +2e- =Cu
(3) ����������6.02��1023������ͨ��ʱ������п0.5mol������0.5mol��65g/mol=32.5g��
�𰸣�32.5

 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�





