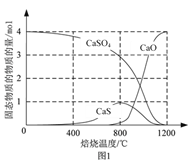
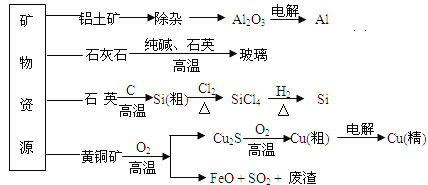
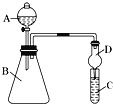
题目内容
【题目】短周期元素的离子:![]() 具有相同的电子层结构,下列关系中不正确的是( )
具有相同的电子层结构,下列关系中不正确的是( )
A. 质子数:![]() B. 还原性:
B. 还原性:![]()
C. 氧化性:![]() D. 半径:
D. 半径:![]()
【答案】A
【解析】
短周期元素的离子:![]() 具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
A.根据a-3=b-1=c+2=d+1,所以质子数:![]() ,故选A;
,故选A;
B.同周期自左向右原子半径逐渐减小,非金属性逐渐增强,非金属性越强,相应阴离子的还原性就越弱,还原性:![]() ,故不选B;
,故不选B;
C.同周期自左向右原子半径逐渐减小,金属性逐渐减弱,金属性越强,离子氧化性越弱,氧化性:![]() ,故不选C;
,故不选C;
D.当电子层结构相同时,核电荷数越大,吸电子能力越强,半径越小,半径:![]() ,故不选D;
,故不选D;
答案:A

【题目】非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
⑴ O2-的电子式为___________;
⑵ O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
⑶ CH3OH在常温下为液态,沸点高于乙烷的主要原因是__________________________;
⑷ Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用____________________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是_________________。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中
c(Cl-) : c(ClO-)=11 : 1时,则c(ClO-) :c(ClO3-)比值等于_____________。
⑸ 镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式___________________________。