题目内容
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是_________(至少答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极
xNiOOH+MHx,试写出放电过程中负极
反应式____________。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为__________,用离子方程式表示出溶液显碱性的原因_______________。
(4)在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。
2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。

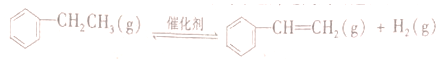
(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢;

①在恒容密闭容器中,控制不同温度进行乙苯的脱氢实验。以乙苯起始浓度均为c mol/L测定乙苯的转化率,结果如图2所示。图中A为乙苯的平衡转化率与温度关系曲线,B曲线表示不同温度下反应经过相同时间且为达到化学平衡时乙苯的转化率。试说明随温度的升高,曲线B向曲线A逼近的原因__________。
②维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转换率为a,则在该温度下反应的平衡常数K=__________(用a等符号表示)。
【答案】 原料来源广;燃烧热值高;污染小;可再生等(或其他合理答案给分) MHx +xOH--xe-= M+xH2O c(Na+) > c(BO2-) > c( OH-) > c( H+ ) BO2-+2H2 O![]() H3BO3+OH- Ⅲ T1 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案给分)
H3BO3+OH- Ⅲ T1 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案给分) ![]()
【解析】(1)与化石燃料相比,氢气作为燃料的优点是原料来源广,燃烧热值高,污染小,可再生等。(2)根据总反应式可知放电过程中负极是MHx失去电子,则负极反应式为 MHx+xOH--xe-=M+xH2O。(3)已知NaBH4与水反应后所得溶液显碱性,这说明BO2-水解,方程式为:BO2-+2H2O![]() H3BO3+OH-,则溶液中各离子浓度大小关系为c(Na+) > c(BO2-) > c( OH-) > c( H+ );(4)该反应正反应为放热反应,根据图1中Ⅰ、Ⅱ、Ⅲ图象,M质量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,M质量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,M质量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以H2转化率最大的反应温度是T1。(5)①由于温度升高,反应速率加快,从而导致达到平衡所需的时间缩短,所以曲线B向曲线A逼近。②根据方程式可知
H3BO3+OH-,则溶液中各离子浓度大小关系为c(Na+) > c(BO2-) > c( OH-) > c( H+ );(4)该反应正反应为放热反应,根据图1中Ⅰ、Ⅱ、Ⅲ图象,M质量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,M质量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,M质量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以H2转化率最大的反应温度是T1。(5)①由于温度升高,反应速率加快,从而导致达到平衡所需的时间缩短,所以曲线B向曲线A逼近。②根据方程式可知
起始量 n 0 0
转化量 na na na
平衡量 n-na na na
反应前后体积不变,则反应后的容积为![]() ,所以该温度下反应的平衡常数K=
,所以该温度下反应的平衡常数K=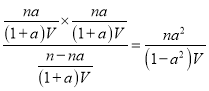 。
。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
