题目内容
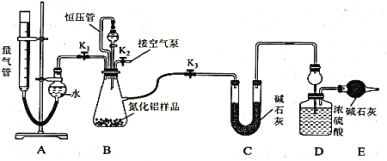
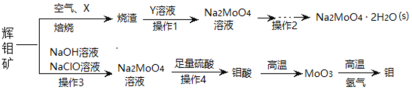
【题目】钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。
回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是________;焙烧时发生反应的化学方程式为__________。
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为_______g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______,操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为__________。
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于______%。
(4)操作3发生反应的离子方程式为_________________。
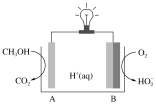
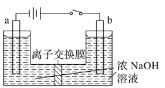
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为______(填“镍”或“钼”),电极反应为___________。
【答案】CaCO3或CaO 6CaCO3+2MoS2+9O2![]() 2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2
2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2![]() 2CaMoO4+4CaSO4 0.08 钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大 重结晶 32.00 MoS2+6OH-+9ClO-=
2CaMoO4+4CaSO4 0.08 钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大 重结晶 32.00 MoS2+6OH-+9ClO-=![]() +2
+2![]() +9Cl-+3H2O 钼 Mo-6e-+8OH-=
+9Cl-+3H2O 钼 Mo-6e-+8OH-=![]() +4H2O
+4H2O
【解析】
根据流程图,辉钼矿的主要成分为MoS2,在空气中焙烧,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X为氧化钙或碳酸钙,发生的反应为6CaCO3+2MoS2+9O2![]() 2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2
2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2![]() 2CaMoO4+4CaSO4,钼酸钙(CaMoO4)微溶于水,烧渣的主要成分为CaMoO4和CaSO4,在烧渣中加入Y溶液,将CaMoO4溶解为Na2MoO4,经过蒸发浓缩、冷却结晶得到Na2MoO4·2H2O晶体;辉钼矿与NaOH、NaClO溶液发生氧化还原反应MoS2+OH-+ClO-=
2CaMoO4+4CaSO4,钼酸钙(CaMoO4)微溶于水,烧渣的主要成分为CaMoO4和CaSO4,在烧渣中加入Y溶液,将CaMoO4溶解为Na2MoO4,经过蒸发浓缩、冷却结晶得到Na2MoO4·2H2O晶体;辉钼矿与NaOH、NaClO溶液发生氧化还原反应MoS2+OH-+ClO-=![]() +2
+2![]() +9Cl-+H2O,得到Na2MoO4溶液,在钼酸钠溶液中加足量硫酸,发生复分解反应生成钼酸和硫酸钠,钼酸属于弱酸,微溶于水,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼;据此分析解答。
+9Cl-+H2O,得到Na2MoO4溶液,在钼酸钠溶液中加足量硫酸,发生复分解反应生成钼酸和硫酸钠,钼酸属于弱酸,微溶于水,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼;据此分析解答。
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X为氧化钙或碳酸钙,发生的反应为6CaCO3+2MoS2+9O2![]() 2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2
2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2![]() 2CaMoO4+4CaSO4,故答案为:CaCO3或CaO;6CaCO3+2MoS2+9O2
2CaMoO4+4CaSO4,故答案为:CaCO3或CaO;6CaCO3+2MoS2+9O2![]() 2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2
2CaMoO4+6CO2↑+4CaSO4或6CaO+2MoS2+9O2![]() 2CaMoO4+4CaSO4;
2CaMoO4+4CaSO4;
(2) 设钼酸钙饱和溶液中c(Ca2+)为x,则c(![]() )为x,由钼酸钙的Ksp=1.6×10-5,解得c(Ca2+)= c(
)为x,由钼酸钙的Ksp=1.6×10-5,解得c(Ca2+)= c(![]() )=4×10-3,则1 L溶液(1 L水中)溶解CaMoO44×10-3mol,即1 000 g水中溶解CaMoO4的质量为4×10-3mol×200 g·mol-1=0.8 g,所以1 00 g水中溶解CaMoO4 0.08 g,即钼酸钙在该温度下的溶解度为0.08g/100g水;由于钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大,所以钼酸钙实际溶解度比计算值大许多;操作2中得到的钼酸钠晶体中常混有Y,可以通过重结晶的方法进一步提纯钼酸钠晶体,故答案为:0.08;钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大;重结晶;
)=4×10-3,则1 L溶液(1 L水中)溶解CaMoO44×10-3mol,即1 000 g水中溶解CaMoO4的质量为4×10-3mol×200 g·mol-1=0.8 g,所以1 00 g水中溶解CaMoO4 0.08 g,即钼酸钙在该温度下的溶解度为0.08g/100g水;由于钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大,所以钼酸钙实际溶解度比计算值大许多;操作2中得到的钼酸钠晶体中常混有Y,可以通过重结晶的方法进一步提纯钼酸钠晶体,故答案为:0.08;钼酸根水解促进钼酸钙溶解平衡右移,溶解度增大;重结晶;
(3) 0.1210g钼酸钠晶体的物质的量为![]() =0.0005mol,根据6CaCO3+2MoS2+9O2
=0.0005mol,根据6CaCO3+2MoS2+9O2![]() 2CaMoO4+6CO2↑+4CaSO4,0.2500g辉钼矿中含有0.0005mol MoS2,辉钼矿中MoS2的质量分数=
2CaMoO4+6CO2↑+4CaSO4,0.2500g辉钼矿中含有0.0005mol MoS2,辉钼矿中MoS2的质量分数=![]() ×100%=32.00%,由于部分钼酸钠溶于水损耗掉,则辉钼矿中MoS2的质量分数不低于32.00%,故答案为:32.00;
×100%=32.00%,由于部分钼酸钠溶于水损耗掉,则辉钼矿中MoS2的质量分数不低于32.00%,故答案为:32.00;
(4)操作3中辉钼矿与NaOH、NaClO溶液发生氧化还原反应生成Na2MoO4,反应的离子方程式为MoS2+6OH-+9ClO-=![]() +2
+2![]() +9Cl-+3H2O,故答案为:MoS2+6OH-+9ClO-=
+9Cl-+3H2O,故答案为:MoS2+6OH-+9ClO-=![]() +2
+2![]() +9Cl-+3H2O;
+9Cl-+3H2O;
(5) 用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4),电解过程中Mo发生氧化反应,根据图示,b为阳极,发生氧化反应,因此b电极的材料为钼,电极反应为Mo-6e-+8OH-=![]() +4H2O,故答案为:钼;Mo-6e-+8OH-=
+4H2O,故答案为:钼;Mo-6e-+8OH-=![]() +4H2O。
+4H2O。

【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:![]() +HNO3
+HNO3![]()
![]() +H2O △H<0,已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
+H2O △H<0,已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质 | 苯 | 硝基苯 | 间二硝基苯 | 浓硝酸 | 浓硫酸 |
沸点/℃ | 80 | 211 | 301 | 83 | 338 |
溶解性 | 微溶于水 | 难溶于水 | 微溶于水 | 易溶于水 | 易溶于水 |
下列说法不正确的是( )
A.分液后的有机层,采用蒸馏的方法可将硝基苯首先分离出来
B.制备硝基苯的反应类型为取代反应
C.该反应温度控制在50~60℃的原因是减少反应物的挥发和副产物的生成
D.采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质