题目内容
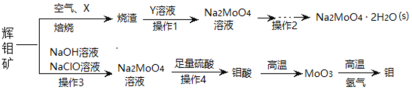
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数。已知①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气(忽略NH3在强碱性溶液中的溶解);③该实验条件下的气体摩尔体积为Vm L/mol,实验装置如下(量气管为碱式滴定管改装)
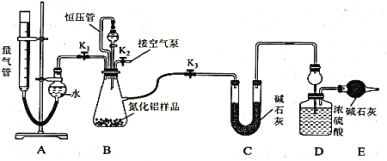
实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。
(1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞______,打开活塞______。
②当_____时,说明反应已经结束。读取读数之前,应对量气管进行的操作为____________;若量气管中的液面高于右侧球形容器中的液面,所测气体体积______(填“偏大”、“偏小”或“无影响”)。
③记录滴定管的读数为y mL,则Al4C3的质量分数为_________(用可能含a、b、x、y、Vm的代数式表示)。
④若无恒压管,对所测Al4C3质量分数的影响是______(填“偏大”、“偏小”或“无影响”)。
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为__________;反应完成后,__________(填该步应进行的操作),最后称得装置D的质量为cg,进而测量AlN的质量分数。
【答案】K2、K3 K1 量气管中液面不再变化 调整量气管高度,使左右两边液面相平 偏小 ![]() 偏大 AlN+OH-+H2O=
偏大 AlN+OH-+H2O=![]() +NH3↑ 打开K2,通入一段时间空气
+NH3↑ 打开K2,通入一段时间空气
【解析】
从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数。
(1)①通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞K1。
②当量气管中液面不再变化时,说明反应已经结束。利用连通器原理,读取读数之前,应对量气管进行的操作为调整量气管高度,使左右两边液面相平;若量气管中的液面高于右侧球形容器中的液面,说明气体的压强大于大气压,所测气体体积偏小。
③甲烷的体积为(x-y)mL,物质的量为![]() ,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为
,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为![]() ,Al4C3的质量分数为
,Al4C3的质量分数为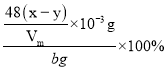 =
=![]() 。
。
④若无恒压管,最终量气管读数偏大,根据上题公式,对所测Al4C3质量分数的影响是偏大。
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,AlN溶于强酸产生铵盐,溶于强碱生成氨气,通过分液漏斗加入氢氧化钠,发生反应的离子方程式为AlN+OH-+H2O=![]() +NH3↑;反应完成后,打开K2,通入一段时间空气,平衡气压,最后称得装置D的质量为cg,进而测量AlN的质量分数。
+NH3↑;反应完成后,打开K2,通入一段时间空气,平衡气压,最后称得装置D的质量为cg,进而测量AlN的质量分数。

【题目】某有机物的结构简式如下:
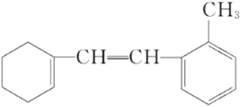
(1)该物质苯环上一氯代物有____________________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为____________________mol;
(3)1 mol该物质和H2加成最多需H2____________________mol;
(4)下列说法不正确的是____________________。
A.此物质可发生加成、取代、氧化等反应 |
B.该物质易溶于水 |
C.该物质能使溴水褪色 |
D.该物质能使酸性KMnO4溶液褪色 |
E.分子式是C15H18