题目内容
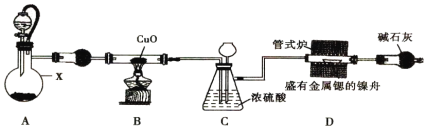
【题目】将NaOH和碳酸氢钠的固体混合物20.8 g在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9 g。试计算原混合物中氢氧化钠的质量分数_________?
【答案】19.2%
【解析】
NaOH和碳酸氢钠的固体混合物置于密闭容器中加热,可能发生的化学反应有:
NaHCO3+NaOH![]() Na2CO3+H2O,盐有多余再发生2NaHCO3
Na2CO3+H2O,盐有多余再发生2NaHCO3![]() Na2CO3+H2O+ CO2↑ 。
Na2CO3+H2O+ CO2↑ 。
以上固体混合物加热失重可能只因第1个反应,也可能有以上二个反应共同造成。
若只有NaHCO3+NaOH![]() Na2CO3+H2O造成,则失重4.9 g对应消耗22.9 g NaHCO3和10.9 g NaOH,相比原混合物20.8 g的总质量,所需反应物不足,说明失重由二个反应共同造成。剩余的15.9g固体都是Na2CO3,其物质的量为0.15mol,根据钠守恒,原NaOH和NaHCO3共0.3mol,总质量为20.8g,设NaOH的物质的量为x,NaHCO3的物质的量为y,则
Na2CO3+H2O造成,则失重4.9 g对应消耗22.9 g NaHCO3和10.9 g NaOH,相比原混合物20.8 g的总质量,所需反应物不足,说明失重由二个反应共同造成。剩余的15.9g固体都是Na2CO3,其物质的量为0.15mol,根据钠守恒,原NaOH和NaHCO3共0.3mol,总质量为20.8g,设NaOH的物质的量为x,NaHCO3的物质的量为y,则![]() ,解得x=0.1,y=0.2。所以m(NaOH)=0.1mol×40g/mol=4.0g,其质量分数为w(NaOH)=
,解得x=0.1,y=0.2。所以m(NaOH)=0.1mol×40g/mol=4.0g,其质量分数为w(NaOH)=![]() ×100%≈19.2%。
×100%≈19.2%。

 名校课堂系列答案
名校课堂系列答案【题目】利用![]() 和
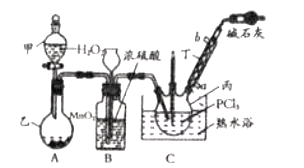
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)