题目内容
【题目】填空:
(1)相同物质的量的二氧化硫和三氧化硫,所含分子的数目之比为__,所含原子数目之比为__,所含氧原子的物质的量之比为__,它们的质量之比为__。
(2)相同质量的二氧化硫和三氧化硫,所含分子的数目之比为_,所含原子数目之比为_,所含氧原子的物质的量之比为__。
【答案】1∶1 3∶4 2∶3 4∶5 5∶4 15∶16 5∶6
【解析】
利用![]() 进行分析;
进行分析;
(1)根据![]() ,二氧化硫和三氧化硫物质的量相同,SO2和SO3所含分子的数目之比等于其物质的量之比,即为1:1;1个SO2分子中含有1个S原子和2个氧原子,即1个SO2分子中含有3个原子,1个SO3分子中含有1个S原子和3个氧原子,即1个SO3含有4个原子,等物质的量的SO2和SO3中所含原子数目之比为3:4;1molSO2中含有2molO原子,1molSO3中含有3molO原子,即等物质的量SO2和SO3中所含氧原子的物质的量之比为2:3;等物质的量SO2和SO3,它们的质量比等于其摩尔质量之比,即为64:80=4:5;
,二氧化硫和三氧化硫物质的量相同,SO2和SO3所含分子的数目之比等于其物质的量之比,即为1:1;1个SO2分子中含有1个S原子和2个氧原子,即1个SO2分子中含有3个原子,1个SO3分子中含有1个S原子和3个氧原子,即1个SO3含有4个原子,等物质的量的SO2和SO3中所含原子数目之比为3:4;1molSO2中含有2molO原子,1molSO3中含有3molO原子,即等物质的量SO2和SO3中所含氧原子的物质的量之比为2:3;等物质的量SO2和SO3,它们的质量比等于其摩尔质量之比,即为64:80=4:5;
答案为1:1;3:4;2:3;4:5;
(2)根据![]() 二氧化硫和三氧化硫质量相同时,它们的分子数之比等于其摩尔质量倒数之比,即
二氧化硫和三氧化硫质量相同时,它们的分子数之比等于其摩尔质量倒数之比,即![]() ∶
∶![]() =5∶4;根据它们的分子组成可知:所含原子数目之比为5×3∶(4×4)=15∶16,氧原子物质的量之比为(5×2)∶(4×3)=5∶6;
=5∶4;根据它们的分子组成可知:所含原子数目之比为5×3∶(4×4)=15∶16,氧原子物质的量之比为(5×2)∶(4×3)=5∶6;
答案为5:4;15:16;5:6。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)有科学家经过研究发现,用CO2和H2在210~ 290℃, 催化剂条件下可转化生成甲醇蒸汽和水蒸气。230℃,向容器中投入0.5mol CO2和1.5mol H2.当CO2平衡转化率达80%时放出的热量为19. 6kJ,写出该反应的热化学方程式∶___________。
(2)在2L密闭容器中,起始投人4mol CO和6mol H2,在一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
温度/℃ | 平衡时CH3OH的物质的量/ mol | 化学平衡常数 |
T1 | 2.6 | K1 |
T2 | 2.0 | K2 |
①则K1_______(填“>”“<”或“=”) K2,原因是_________________。
②在T2下,经过10s达到化学平衡状态,则0~ 10s内H2的平均速率v(H2)为_______,若维持条件不变再向容器中充入CO、H2和CH3OH各1mol,则v正_________(填“>”“<”或“=”)v逆。
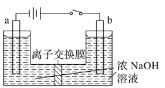
(3)某科研小组设计的一个氮氧化物原电池 ,两边的阴影部分为 a、b惰性电极,分别用导线与烧杯的m、n惰性电极相连接,工作原理如图:

①b极的电极反应式为_______________________。
②当有0.2mol O2-通过固体电解质时,则烧杯中m处的产物的物质的量为________。
(4)处理烟气中SO2,也可采用碱液吸收法,已知25°C时,K(NH3 H2O)=1.8×10-5; Kcp(CaSO4)=7.1×10-5.
第1步∶用过量的浓氨水吸收SO2,并在空气中氧化;
第2步∶加入石灰水,发生反应![]() K。计算第2步中反应的K=_____________(列出计算式即可)。
K。计算第2步中反应的K=_____________(列出计算式即可)。