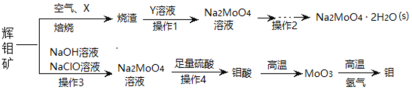
题目内容
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)ΔH3=__kJ·mol-1。
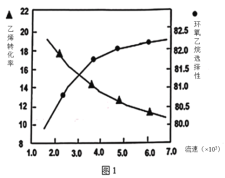
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是__。
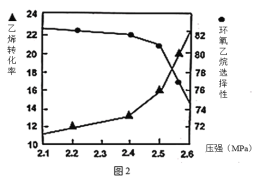
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__。
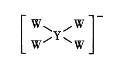
(3)实验测得反应Ⅰ中,υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为__。
②若平衡后仅升高温度,则下列说法正确的是___。
A.x(CH2=CH2)增大,x(![]() )减小
)减小
B.K正与K逆的比值增大
C.υ正减小,υ逆增大
D.K正与K逆的比值减小
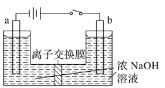
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2Cl],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如图所示。
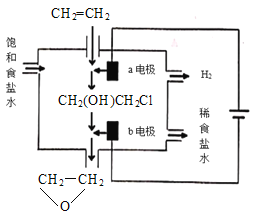
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为__(选填“阴极”或“阳极”),其电极反应式为:__。
②b电极区域生成环氧乙烷的化学方程式为__。
【答案】-2438 流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降 压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低 36 AD 阳极 2Cl--2e-=Cl2 CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O
+NaCl+H2O
【解析】
(1)主反应Ⅰ:①2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:②CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:③2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
根据盖斯定律,将②×2-①得反应③2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3=-2438kJ·mol-1。故答案为:-2438;
4CO2(g)+4H2O(g) ΔH3=-2438kJ·mol-1。故答案为:-2438;
(2)①图1随进料气的流速加快,乙烯的转化率下降,其可能原因是流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降。故答案为:流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降;
②图2当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低。故答案为:压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低;
(3)①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,

平衡时乙烯、氧气、环氧乙烷物质的浓度分别是:0.5mol·L-1、0.25mol·L-1、1.5mol·L-1,![]() =36,则该反应平衡常数的值为36。故答案为:36;
=36,则该反应平衡常数的值为36。故答案为:36;
②A.反应是放热反应,升高温度,平衡逆向移动,x(CH2=CH2)增大,x(![]() )减小,故A正确;
)减小,故A正确;
B.υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),达到平衡时υ正=υ逆,则
),达到平衡时υ正=υ逆,则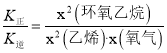 ,升高温度,正、逆反应速率都增大,逆反应速率增大的倍数大于正反应速率增大的倍数,则K正与K逆的比值减小,故B错误;
,升高温度,正、逆反应速率都增大,逆反应速率增大的倍数大于正反应速率增大的倍数,则K正与K逆的比值减小,故B错误;
C.升高温度,υ正增大,υ逆增大,故C错误;
D.由B项分析知,K正与K逆的比值减小,故D正确;
故选AD;
(4)①a连接电源正极,a电极为阳极,发生氧化反应生成氯气,其电极反应式为:2Cl--2e-=Cl2。故答案为:阳极;2Cl--2e-=Cl2;
②b为阴极,生成NaOH,CH2(OH)CH2Cl与氢氧化钠溶液反应生成环氧丙烷和NaCl,b电极区域生成环氧乙烷的化学方程式为CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O;故答案为:CH2(OH)CH2Cl+NaOH→
+NaCl+H2O;故答案为:CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O。
+NaCl+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是
2NH3(g)ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响P2>P1 | 温度对反应的影响 | 平衡体系增加氮气对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. AB. BC. CD. D
【题目】某有机物的结构简式如下:
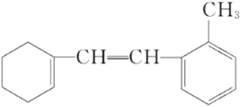
(1)该物质苯环上一氯代物有____________________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为____________________mol;
(3)1 mol该物质和H2加成最多需H2____________________mol;
(4)下列说法不正确的是____________________。
A.此物质可发生加成、取代、氧化等反应 |
B.该物质易溶于水 |
C.该物质能使溴水褪色 |
D.该物质能使酸性KMnO4溶液褪色 |
E.分子式是C15H18