题目内容
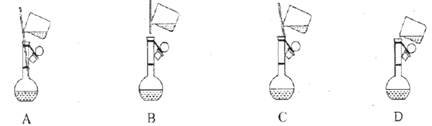
【题目】下列有关容量瓶的四种说法,正确的一组是
①标有使用温度、容积和一条刻度线;
②不宜贮存溶液;
③不能用来加热,不能作反应器;
④使用之前要检查是否漏水;
⑤容量瓶用蒸馏水洗净后,应干燥后再配制溶液。
A. 仅①②③④ B. 仅②③ C. 仅①②④⑤ D. 仅②③④
【答案】A
【解析】
容量瓶是配制一定物质的量浓度的溶液用的精确仪器,它是一种带有磨口玻璃塞的细长颈、梨形的平底玻璃瓶,标有温度和容量,颈上有刻度;使用时要先检验是否漏水,容量瓶不能进行加热,容量瓶只能用于配制溶液,不能长时间或长期储存溶液,正确的有①②③④,故选A。

【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) ![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色。
往上述溶液中加入氢氧化钠溶液呈_______色,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压强或温度),平衡就会向着_________这种改变的方向移动;
(2)在KMnO4与H2C2O4反应中,可通过测定_________________的时间来测定该反应的速率;
此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)。
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①淀粉溶液的作用是__________________________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,
试推测该实验结论: ____________________________________________________。