题目内容
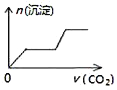
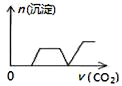
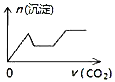
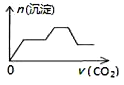
【题目】某温度时,在容积为2 L的密闭容器中,A、B的物质的量随时间变化的曲线如图所示,请据图回答下列问题:
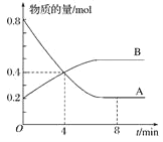
(1)该反应的化学方程式为_______________。
(2)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上填“>”、“<”或“=”)。
(3)反应开始至4 min时,A的平均反应速率为_______________________。
(4)4 min时,反应是否达到平衡状态?________(填“是”或“否”)。8 min时,υ(正)________(填“>”、“<”或“=”)υ(逆)。
【答案】2A![]() B = > 0.05 mol/(L·min) 否 =
B = > 0.05 mol/(L·min) 否 =
【解析】
(1)根据物质的量的变化判断反应物和生成物,再根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据图象先判断二者的物质的量多少,然后利用c=![]() 比较浓度大小;然后根据物质的起始物质的量、4min时的物质的量比较二者物质的量变化多少结合c=
比较浓度大小;然后根据物质的起始物质的量、4min时的物质的量比较二者物质的量变化多少结合c=![]() 比较浓度变化大小;
比较浓度变化大小;
(3)根据υ=![]() 计算反应速率υ;
计算反应速率υ;
(4)由图象观察4min后物质的浓度是否发生变化判断是否为平衡状态;根据8min时物质的量的情况判断平衡状态。
(1)根据图象可知:A的物质的量减少,B的物质的量在增加,可知A是反应物,B是生成物,在4min内A、B变化的物质的量之比为2:1,且8min后两种物质都存在,物质的量不再发生变化,所以该反应是可逆反应,方程式为:2A![]() B;
B;
(2)由图象可知在4 min末时,A、B的物质的量相等,由于容器的容积相同,所以根据 c=![]() 可知A、B物质的量浓度之比等于二者的物质的量的比,c(A)=c(B);从0~4 min内A、B的物质的量浓度变化量Δc(A)=
可知A、B物质的量浓度之比等于二者的物质的量的比,c(A)=c(B);从0~4 min内A、B的物质的量浓度变化量Δc(A)=![]() =0.2mol/L,Δc(B)=
=0.2mol/L,Δc(B)=![]() =0.1mol/L<0.2mol/L,所以Δc(A)>Δc(B);
=0.1mol/L<0.2mol/L,所以Δc(A)>Δc(B);
(3)反应开始至4 min时,A的平均反应速率为υ(A)=![]() =0.05 mol/(L·min);
=0.05 mol/(L·min);
(4)由图象可知4 min后A的物质的量仍减小,B的物质的量仍增加,可见反应向正反应方向进行,因此反应未达到平衡状态;在8 min时,反应混合物中任何一组分的物质的量不变,则物质的浓度不变,反应达到平衡,用同一物质表示的正反应速率和逆反应速率相等,所以υ(正)=υ(逆)。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案